Ketogeeninen ruokavalio ja epilepsia
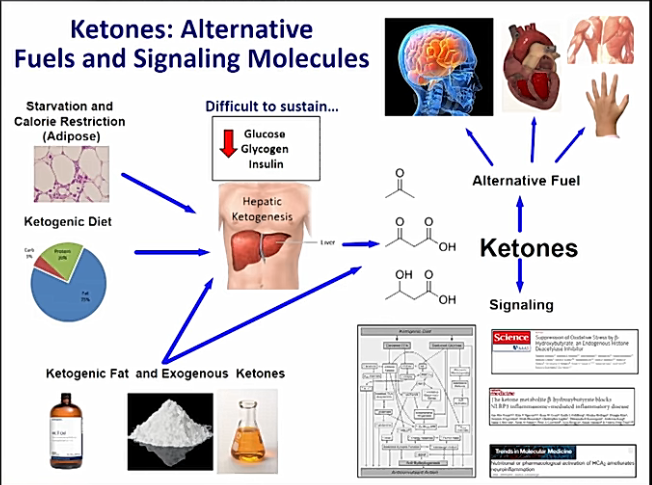
Ketogeenisen ruokavalion neuroprotektiiviset ominaisuudet on tunnettu pitkään. Jo vuosisadan ajan lasten lääkeresistenttia epilepsiaa on hoidettu ketogeenisellä ruokavaliolla. Kuva ketogeenisen ruokavalion neuroprotektiivisista vaikutuksista tarkentuu jatkuvasti.
Ketogeenisen ruokavalion (KD) hyöty epilepsian ja eräiden muiden neurologisten häiriöiden terapiana hyväksytään laajalti, mutta sen kaikkia toimintamekanismeja ei täysin tunneta.
KD:n noudattaminen johtaa merkittäviin metabolisiin muutoksiin. Eräs tärkeimmistä metabolisista muutoksista on ketoosi. Toisaalta ketogeeninen ruokavalio lisää myös monityydyttämättömien rasvahappojen pitoisuutta ja laukaisee solujen puhdistusjärjestelmän, eli autofagian, joka hidastaa solujen ikääntymistä ja siivoaa soluista erilaisia kuona-aineita.
Nämä ”primaariset” vaikutukset johtavat ”toissijaisiin”, osittain adaptiivisiin vaikutuksiin, esimerkiksi muutoksiin mitokondrioiden tiheydessä ja geeniekspressiossa. Kliinisesti ruokavalion vaikutuksia pidetään epileptisiä kouristuksia estävinä ja neuroprotektiivisina.
Ketogeenisen ruokavalion aineenvaihduntamekanismien mahdollisiä kliinisiä, neuroprotektiivisia ja kognitiivisia vaikutuksia tutkitaan laajasti NASA:a ja Yhdysvaltojen puolustusministeriötä myöten.
1. Ketogeenisen ruokavalion metabolia
Ketogeenisen ruokavalion (KD) arvo epilepsian hoidossa tunnustetaan, vaikka tarkat mekanismit, joilla se vaikuttaa, ovat edelleen osin selvittämättä [1]. Ketogeenisen ruokavalion tuottamat metaboliset muutokset ovat kuitenkin erilaisia kuin epilepsialääkkeiden (AED) [2] vaikutusmekanismit. Näiden mekanismien selvittäminen voi johtaa ketogeenisen ruokavalion hyödyntämiseen myös muiden neurologisten sairauksien terapiana [3].
KD koostuu neljästä elementistä, joista minkä tahansa muutokset voivat selittää sen kouristuksia ehkäiseviä eli antikonvulsantteja vaikutuksia:
- lisääntynyt rasvan määrä, yleensä suhteessa 3-4 grammaa rasvaa kutakin proteiini- ja hiilihydraattigrammaa kohti
- mahdollisimman pieni glukoosin kulutus
- kalorirajoitus
- nesterajoitus
[1] Vaikka viimeisestä elementistä (4) on esitetty jonkin verran kritiikkiä, kliininen käytäntö on osoittanut, että nesteen rajoittamisen lopettaminen voi johtaa kohtausten uusiutumiseen hyvin samalla tavalla kuin lopetettaessa glukoosirajoitus.
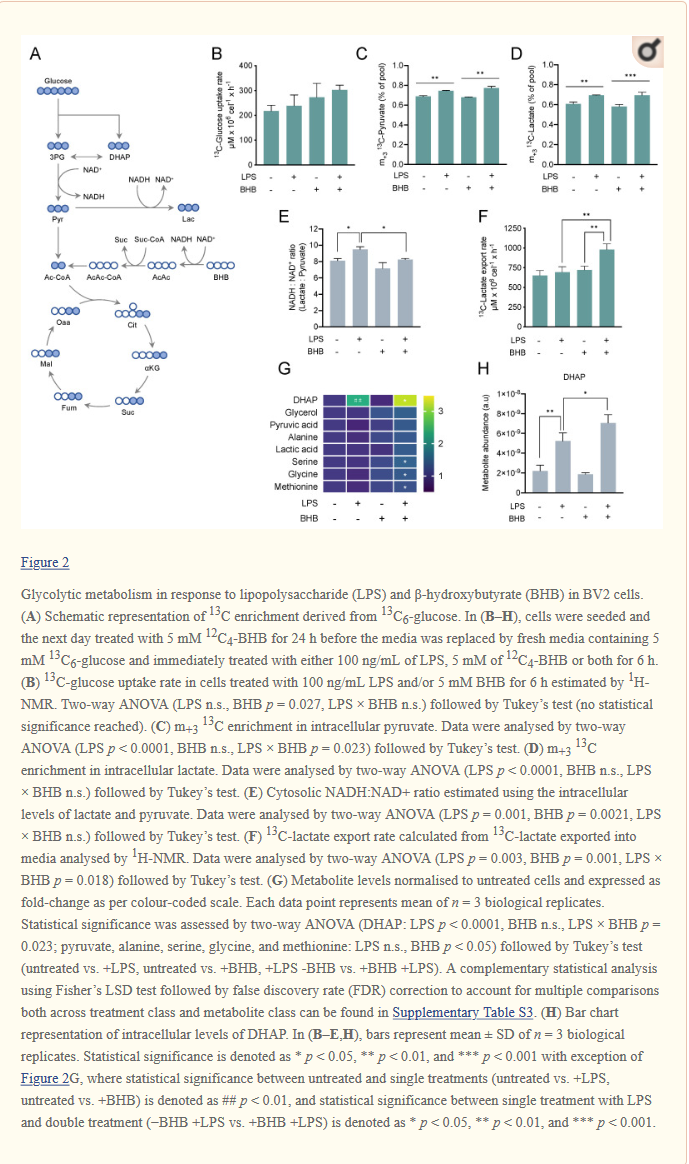
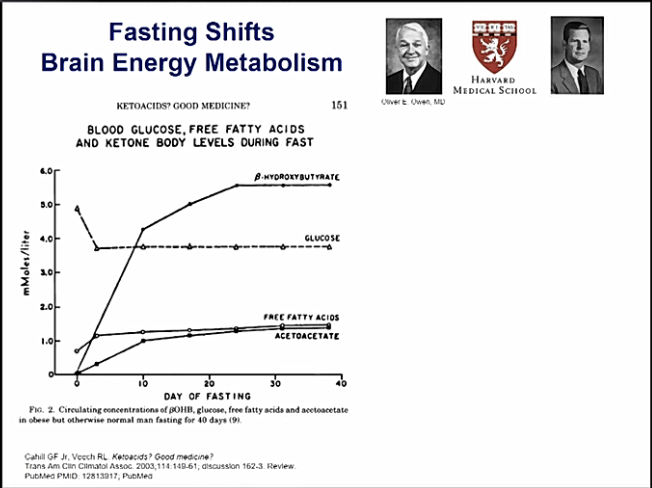
KD: n noudattaminen johtaa krooniseen ketoosiin [5]. Ruokavalion noudattamisen tärkein tulos on vapaiden rasvahappojen (FFA) pitoisuuden lisääntyminen veressä. Vapaat rasvahapot (FFA) kuljetetaan mitokondrioihin, jossa ne päätyvät β -oksidatiiviseen prosessiin. Tämä β-oksidaatio, jossa vapaat rasvahapot hajotetaan ketoneiksi, edellyttää karnitiinia.

Kuva: Ketogeenisen ruokavalion metaboliset muutokset
Ketoaineisiin kuuluvat β-hydroksibutyraatti, asetoasetaatti ja asetoni [5]
1.1. Ketoaineiden merkitys
Ketoneiden (asetonin, asetoasetaatin ja beta-hydroksibutyraatin) lisääntynyt pitoisuus veressä voi olla ketogeenisen ruokavalion merkittävin epileptisiä kohtauksia hillitsevistä metabolisista vaikutuksista.
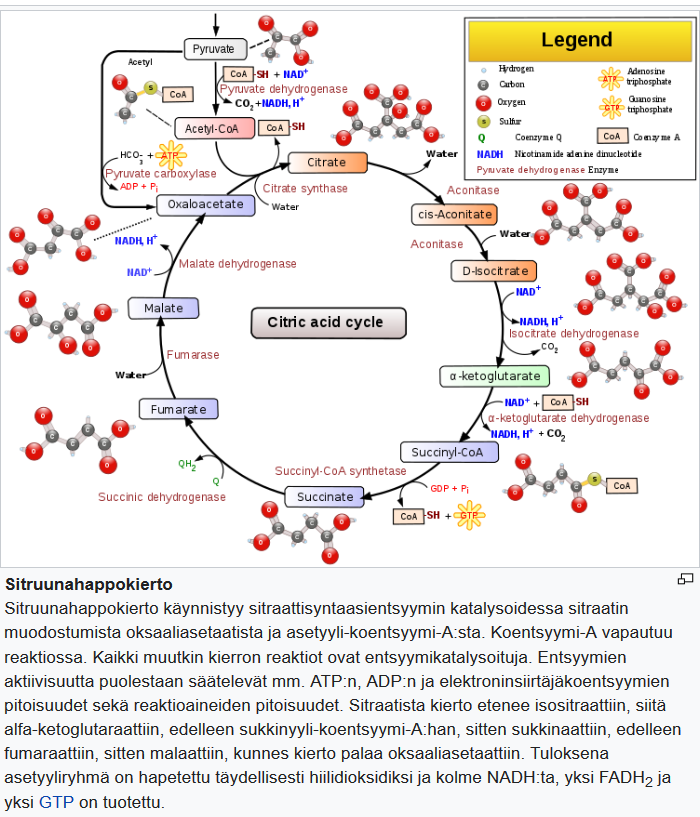
Ketoaineiden hajoaminen toimittaa asetyyli-CoA:n suoraan trikarboksyylihapposykliin, mikä tehostaa energia-aineenvaihduntaa. Samalla tämä aineenvaihduntakanava kiertää glykolyysissä syntyvän asetyylikoentsyymi-A:n tarpeen ATP:n tuotannossa.
Toisin kuin glukoosi, joka vaatii kuljettajan läpäistäkseen veri-aivoesteen, ketoaineet läpäisevät veri-aivoesteen helposti. Kun kuljetusmolekyyleistä, kuten glut 1, on puutetta, KD on suositeltava epilepsiaterapia, koska sen avulla on mahdollista kiertää solujen glukoosin tarve [1]. Lapset, joilla pyruvaatin muuntuminen asetyyli-CoA:ksi on estynyt esimerkiksi pyruvaattidehydrogenaasin (PDH) puutteessa, hyötyvät glukoosin aineenvaihduntareitin ohittamisesta [3].
β-hydroksibutyraatti on veressä mitattavista ketoneista hallitseva ketoaine, ja sitä käytetään ketoosin asteen seuraamiseen terapian aikana. Beta-hydroksibutyraatin hajoaminen johtaa lisääntyneeseen asetonin tuotantoon [6].
Asetoni on yksi ketoaineista, joilla on kouristuksia hillitsevä, eli antikonvulsanttinen vaikutus erilaisissa hiirien kliinisissä kohtausmalleissa [7]. Tämän vaikutusmekanismia ei tunneta, vaikka vaikutusta K2p-kanaviin pidetään mahdollisena [5]. TCA-syklin (sitruunahappokierron) avulla asetyyli-CoA lisää hermovälittäjäaineiden glutamaatin ja gamma-aminovoihapon (GABA) ja vastaavasti tärkeimpien aivojen eksitatoristen ja estävien välittäjäaineiden määrää aivoissa.
| Gamma-aminovoihappo eli GABA on tärkein aivojen ja muun keskushermoston hermosolujen toimintaa jarruttava välittäjäaine. GABA:n välittämä viesti on luonteeltaan inhibitorinen eli vaimentava tai lamaava: GABA välittää hermosolulle käskyn vähentää toimintaa tai lopettaa toimintansa. Noin 40 % aivosoluista reagoi gamma-aminovoihapon inhibitoriseen vaikutukseen. Yksittäisissä neuroneissa GABAn vaikutus voi olla myös eksitoiva eli kiihdyttävä. Elimistön tärkein kiihottava välittäjäaine, GABA:n vastavaikuttaja, on glutamaatti. |
| GABA:n nauttiminen lisää kasvuhormonin ja prolaktiinin synteesiä. GABA voi auttaa nukahtamisvaikeuksista kärsiviä ja parantaa unen laatua. |
| GABA- eli gamma-aminovoihapporeseptoreita on kahta päätyyppiä; GABAA ionikanavareseptori ja GABAB G-proteiinikytkentäinen reseptori. GABAC tunnetaan nykyään GABAA-rho reseptorina. Myös reseptorien alatyyppejä tunnetaan. |
| Monet rauhoittavat lääkeaineet kuten bentsodiatsepiinit ja barbituraatit lisäävät hermoston GABA-aktiivisuutta aiheuttaen hermoratojen toiminnan epäspesifiä, yleistynyttä hidastumista. Bentsodiatsepiiniryhmään kuuluvat lääkeaineet sitoutuvat bentsodiatsepiinireseptoreihin, GABAA-reseptorin alatyyppiin aiheuttaen positiivisen allosteerisen modulaation johtaen kloridikavanan avautumistaajuuden kiihtymiseen. Barbituraattien vaikutusmekanismi on hieman erilainen, ne pidentävät suoraan kloridikanavan aukioloaikaa sitoutumalla GABAA β-aliyksikköön. Tässä on syy barbituraattien myrkyllisyyteen bentsodiatsepiineihin verrattuna yliannostustapauksissa. Näitä reseptoreita on sekä aivoissa että sisäelimissä. |
| Myös monet epilepsialääkkeet (esimerkiksi valproaatti, vigabatriini, gabapentiini ja topiramaatti) tehostavat elimistön oman GABA:n vaikutusta. |
| Baklofeeni (Baclon, Baclopar, Lioresal) on GABAB-agonisti eli se jäljittelee GABA:n vaikutusta elimistössä ja sitoutuu GABAB-reseptoreihin. Baklofeenia käytetään yleisimmin keskushermoston toiminnan aiheuttaman liiallisen lihasjänteyden ja spasmien hoidossa. Sairauksia, joissa baklofeenia yleisesti käytetään, ovat muun muassa MS-tauti ja selkäydinvammat. Baklofeenista voi olla apua dystoniaan. |
| GABA:n puute voi aiheuttaa ahdistuneisuutta, masentuneisuutta ja epileptisiä kohtauksia. |
| GABA transaminaasi entsyymi katalysoi gamma-aminovoihapon ja 2-oksoglutaraatin muuntumista sukkiinisemialdehydiksi ja glutamaatiksi. Sukkiinisemialdehydin taas hapettaa sukkiinihapoksi sukkiinisemialdehydi dehydrogenaasientsyymi, ja sen jälkeen se on käypä energianlähde sitruunahappokierrossa. – Wikipedia |
GABAn lisääntynyt vaikutus keskushermostossa voi selittää ketogeenisen ruokavalion kouristuksia hillitsevää vaikutusta[5].
1.2. Monityydyttymättömien rasvahappojen (PUFA) merkitys
Vapaiden rasvahappojen lisääntymisen seurauksena on monityydyttymättömien rasvahappojen (PUFA) pitoisuuden kasvu.
PUFA:n potentiaalinen kyky estää kohtauksia aivoissa saattaa liittyä melko monimutkaisiin mekanismeihin, kuten:
- sähköisen jännitteen rajoittamien natrium- ja kalsiumkanavien estäminen
- lipidille herkän kaliumkanavan aktivointi
- hermosolujen stimulaatiota rajoittavan natriumpumpun aktiivisuuden tehostaminen
- peroksisomiproliferaattorilla aktivoituvan reseptori-a:n (PPARa) aktivoiminen
- PUFA indusoi aivospesifisten irrotusproteiinien ilmentymistä ja aktiivisuutta mitokondrioissa, vaikuttaen siten neuroprotektiivisesti
[5]. Tämä viimeinen vaikutus toimii rajoittamalla reaktiivisten happiradikaalien (ROS) syntymistä.
1.3. Bioenergetiikka ja neuroprotektiivinen
Ketogeenistä ruokavaliota on ensisijaisesti pidetty epileptisia kouristuksia ehkäisevänä. KD-ruokavalion tutkimukset viittaavat paljon laajempiin ja monimutkaisempiin nuroprotektiivisiin vaikutuksiin.
Neuroprotektiivisuus voi vaikuttaa antikonvulsanttisesti (kouristuksia ehkäisevästi), mutta sillä on myös muita merkittäviä metabolisia vaikutuksia [3]. Kaiken kaikkiaan KD:n noudattaminen lisää ja tehostaa energian tuotantoa aivoissa. Appleton ja De vivo [8] kertoivat, että KD lisäsi bioenergeettisten substraattien (adenosiinitrifosfaatti (ATP)) kokonaismäärää ja nosti energian varausta rottien aivoissa.
Asetoasetaatti, beta-hydroksibutyraatin dehydraustuote, muutetaan asetyylikoentsyymi-A:ksi, joka kulkeutuu trikarboksyylihapposykliin (TCA), eli sitruunahappokiertoon.
| Asetyylikoentsyymi-A eli aktiivinen etikkahappo on kaikille ravintoaineille yhteinen välituote solun valmistaessa energiaa. Asetyylikoentsyymi-A:ta saadaan monosakkarideista, triglyserideistä sekä aminohapoista erilaisten reaktiovaiheiden kautta.Asetyylikoentsyymi-A:n asetyyliryhmän hiilet (C) hapettuvat hiilidioksidiksi TCA-syklissä ja vedyt (H) siirtyvät erityisten koentsyymien avulla elektroninsiirtoketjuun. Näissä reaktioissa syntyy energiaa, joka varastoidaan fosfaattiyhdisteisiin, esimerkiksi ATP:ksi.
Solujen energialähteinä toimivat ensi sijassa hiilihydraatit ja rasvahapot, mutta muitakin molekyylejä esimerkiksi aminohappoja voidaan käyttää. Aminohappojen käyttö energialähteenä on tosin normaalitilanteissa vähäistä. Glukoosi hajoaa glykolyysissä kahdeksi pyruvaatiksi, joista edelleen molemmista saadaan oksidatiivisessa dekarboksylaatiossa kaksi asetyylikoentsyymi-A:ta. Jos taas happea (O) ja mitokondrioita ei ole tarpeeksi saatavilla, pyruvaatti pelkistyy edelleen maitohapon anioniksi laktaatiksi. Rasvahapot hajoavat pääasiassa hapettumalla β-oksidaatiossa niin, että rasvahappoketjusta irtoaa kahden hiilen asetyyliryhmiä, jotka ovat kiinnittyneenä reaktioon osallistuvaan koentsyymi-A:han.
|
TCA-syklin lisääntynyt energiatuotanto tuottaa protoneja ja elektroneja, jotka kanavoituvat elektronien siirtoketjuun. Tämä puolestaan lisää ATP:n muodostumista adenosiinidifosfaatista (ADP) ATP-syntaasin avulla.
ATP voidaan joko muuttaa fosfokreatiiniksi energian varastointia varten tai hajottaa adenosiiniksi. Lisääntyneet ATP-tasot tarjoavat energiavaroja hermosolun toiminnan ylläpitämiseksi myös silloin, kun solun glukoosinotto on häiriintynyt. Lisääntynyt solunulkoinen adenosiini toimii eräänlaisena neuroprotektiivisena puskurina laskemalla jännitettä ja estämällä siten paikallisia kohtauksia [6].
On myös arveltu, että KD vaikuttaa energiametaboliaentsyymejä koodaavien transkriptiotekijöiden säätelyyn (ylösregulointiin) ja mitokondrioiden tiheyden lisääntymiseen hermosoluissa, mikä johtaa kasvaneisiin energiavarastoihin.
Energian saannin helpottuminen voi tukea kohtausten ehkäisemistä esimerkiksi tukemalla GABAergistä estoa [9].
| Wikipedia:Aivojen välittäjäaineet ovat kemiallisia välittäjämolekyylejä, jotka välittävät (eksitoivat, inhiboivat tai moduloivat) signaaleja aivojen hermosolujen eli neuronien välillä. Eksitoiva välittäjäaine kiihdyttää, inhiboiva välittäjäaine jarruttaa aivotoimintaa. Välittäjäaineet eli neurotransmitterit siirtyvät neuronien välillä synapseissa.Keskushermoston eli aivojen ja selkäytimen tärkeimpiä neurotransmittereita ovat aminohapot. Noin 80–90 prosentissa keskushermoston synapseista välittäjäaineena toimii aminohappo, 5–10 prosentissa amiini ja 1–2 prosentissa peptidi.
Aivoissa tärkeitä aminohappotransmittereita ovat muun muassa glutamaatti ja glysiini, joista edellinen saattaa olla aivojen tärkein kiihdyttävä välittäjäaine. Glutamaatilla on kolmentyyppisiä reseptoreita. Ne on nimetty niille suhteellisen spesifien agonistien mukaan N-metyylidekstroaspartaatti (NMDA)-, kainaatti- ja 1-amino-3-hydroksi-5-metyyli-iso-oksatsoli-4-propionaatti (AMPA)-reseptoreiksi; mahdollisesti on olemassa muunkin tyyppisiä reseptoreita. Gamma-aminovoihappo eli γ-aminovoihappo eli GABA on tärkein aivojen toimintaa jarruttava välittäjäaine. Jopa yli kolmasosa aivojen synapseista on GABAergisiä. GABA:lla on monia reseptoreita, esimerkiksi GABAA ja GABAB. Glutamaatti ja GABA muodostavat ikään kuin eksitoiva/inhiboiva välittäjäaineparin aivoissa. Aminohapoista yksinkertaisin eli glysiini toimii inhibitorisena välittäjäaineena keskushermostossa. Sen reseptoreita löytyy etupäässä selkäytimestä. Glysiinin välittäjäaineparina etupäässä selkäytimen alueella toimii eksitoiva aminohappo aspartaatti. Asetyylikoliinin vaikutus aivokuorella ja hippokampuksessa on pääosin eksitoiva; myös inhibitiota saattaa esiintyä, mutta se on liitetty viereisten inhiboivien GABAergisten solujen aktivaatioon. Alzheimerin taudissa asetyylikoliiniradat isoaivokuorelle ja hippokampukseen vaurioituvat, mikä aiheuttaa dementian. Noradrenaliinia on runsaasti aivorungon pienissä locus coeruleus -tumakkeissa, joista lähtevät aksonit haarautuvat eri tahoille, muun muassa hypotalamukseen, pikkuaivoihin ja isoaivokuorelle. Noradrenaliini osallistuu muun muassa vireystilan säätelyyn. Dopamiinia sisältäviä neuroneja on runsaasti erityisesti keskiaivoissa substantia nigran ja tegmentumin tienoilla. Näiden aksonit haarautuvat laajalle alueelle. Aivoissa on neljä dopaminergista päärataa: mesokortikaalinen, mesolimbinen, nigrostriataalinen ja tuberoinfundibulaarinen. Nigrostriataalisen radan tuhoutuessa ilmentyy Parkinsonin tauti. Skitsofrenian ajatellaan johtuvan mesokortikaalisen ja mesolimbisen radan dopamiinin D2-reseptorien ylistimuloitumisesta. Serotoniinia eli 5-hydroksitryptamiinia sisältävien hermosolujen soomaosista suurin osa sijaitsee ydinjatkoksen keskiviivalla olevassa raphe-tumakkeessa. Näiden neuronien aksonit ulottuvat aivojen kaikkiin osiin. Serotoniini osallistuu muun muassa tunne-elämän, muistin, syömiskäyttäytymisen ja ruumiinlämmön säätelyyn. Histamiinia on ennen muuta hypotalamuksen corpora mamillare -alueella olevissa neuroneissa, jotka projisoituvat useimpiin aivojen osiin. Keskushermostossa histamiini osallistuu muun muassa neuroendokriiniseen säätelyyn, uni-valverytmin, vireystilan ja ruokahalun säätelyyn. Edellä mainittujen välittäjäaineiden lisäksi aivoissa vaikuttaa muun muassa suuri määrä erilaisia neuropeptidejä. |
Merkittävimmät |
|
Muut |
On esitetty hypoteesi, jonka mukaan metaboliset sopeutumisprosessit ruokavalion aiheuttamiin muutoksiin aiheuttaa muutoksia geeniekspressiossa, mikä puolestaan johtaa joihinkin edellä mainituista muutoksista. Muu neuroprotektiivinen polku moduloidaan vähentämällä reaktiivisten happiradikaalien muodostumista, jonka katsotaan liittyvän monityydyttämättömien rasvahappojen vaikutukseen solujen irrotettavissa proteiineissa [5].
1.4. Ketogeenisen ruokavalion muita kliinisiä etuja
Ketogeenistä ruokavaliota pidetään todistetusti toimivana terapiamuotona, jolla on hyvin vähän haitallisia vaikutuksia. Laaja KD-terapiaa tukeva kliininen näyttö erityisesti lapsilla esiintyvän epilepsian hoitona on johtanut viimeaikaisiin laajempiin tutkimuksiin ketogeenisen ruokavalion metabolisista hyödyistä esimerkiksi neurodegeneratiivisten sairauksien hoidossa[3].
Eräs mielenkiintoisimmista ja aktiivisimmista tutkimusalueista on runsaasti rasvaa sisältävän kaloripitoisen ruokavalion vaikutus aivokasvainsolujen selviytymiseen. Aivosyöpäsoluilla on rajoitettu metabolinen joustavuus. Ne ovat hyvin riippuvaisia glukoosimetaboliasta.
Mitokondrioiden poikkeavuudet heikentävät aivokasvainten kykyä tuottaa energiaa ketoaineista. Toisin kuin normaaleissa soluissa, pahanlaatuisilla kasvainsoluilla on heikentynyt geneettinen sopeutumiskyky muuttuviin energiasubstraatteihin. Niiden energiansaanti rajoittuu lähinnä glukoosiin, minkä vuoksi paasto, niukkaenerginen ruoka ja ketogeeninen ruokavalio heikentävät syöpäsoluja. Näitä samoja aivokasvainten kehittymiseen liittyviä geneettisiä vikoja voidaan hyödyntää pahanlaatuisten solujen tuhoamisessa [3, 10, 11].
Vuonna 1995 Nebeling et al. [12] raportoi kahdesta nuoresta tytöstä, joilla oli pitkälle edennyt aivokasvain. Tyttöjen syövät reagoivat heikosti sädehoitoon ja kemoterapiaan. Lopulta tyttöjä päätettiin hoitaa ketogeenisella ruokavaliolla. Heidän vasteensa KD-hoidolle oli merkittävä sekä kliinisesti että positroniemissiotomografian seurantatutkimusten mukaan.
Zuccoli et al. [13] kuvasi potilasta, jolla oli erittäin pahanlaatuinen multippeli glioblastoma ( kasvain), joka parani ketogeenisella ruokavaliolla. Hullua kyllä, hoidon houkuttelevasta tehokkuudesta ja hyvistä alustavista tuloksista huolimatta aivokasvainten hoitoa ketogeenisellä ruokavaliolla ei ole sittemmin kliinisesti tutkittu ihmisillä. Miksi?
Useat hiiri- ja rotamalleilla tehdyt laboratoriotutkimukset ovat äskettäin vahvistaneet, että aivokasvaimen kasvun estyminen liittyy suoraan alentuneisiin glukoosipitoisuuksiin ja kohonneisiin ketoaineiden pitoisuuksiin. Lisäksi KD:n osoitettiin vähentävän aivojen reaktiivisia happiradikaaleja (ROS) [5].
Syöpäsolut tarvitsevat korkeita ROS-tasoja angiogeneesin indusoimiseksi ja kasvainten kasvutekijöiden tuottamiseksi [11], joten tämä mekanismi selittää KD:n vaikutusta.
Esimerkki:
12-vuotiaalla tytöllä todettiin keskushermostoon vaikuttava neurokutaaninen melanoosi Kasvain oli erittäin pahanlaatuinen ja eteni nopeasti. Kliiniset oireet olivat pääasiassa vaikeita kohtauksia, jotka edellyttivät toistuvaa pääsyä tehohoitoyksikköön sekä kohtausten lisäksi vakavia kognitiivisia ja valppauteen liittyviä oireita. Kun onkologit päättivät, että kasvainten vastainen hoito olisi tehotonta, tyttöä ryhdyttiin hoitamaan ketogeenisella ruokavaliolla. Neljän viikon kokeilun jälkeen KD:llä ei ollut mitään vaikutusta kasvaimen etenemiseen. Kohtausten taajuus ja vakavuus parani, mutta häntä hoidettiin samanaikaisesti AED:n kanssa. Ketogeenisellä ruokavaliolla oli kuitenkin huomattava parantava vaikutus tytön kognitioon, valppauteen ja mielialaan sairauden vakavuudesta ja etenemisestä huolimatta.
KD:n myönteinen vaikutus kognitioon, valppauteen ja mielialaan tunnetaan hyvin [1]. Tämä voi olla erityisen tärkeää nuorten vakavien kasvainten etenevissä vaiheissa. KD:n mahdollinen neuroprotektiivinen vaikutus motivoi tutkimuksia sen potentiaalista hoitovaihtoehtona muissa neurologisissa häiriöissä [3].
Yhä useammat eläintutkimukset osoittavat, että paastolla ja ketogeenisellä ruokavaliolla saavutetulla ketoosilla on selkä ja johdonmukainen neuroprotektiivinen vaikutus erilaisisten aivovaurioiden jälkeen.
Yksi ihmisillä toteutettu pienimuotoinen pilottitutkimus ja useat eläinmallitutkimukset ovat osoittaneet autististen käyttäytymisparametrien parantuneen KD-hoidolla. Vielä on selvitettävä, liittyykö tämä vähentyneeseen epileptiseen aktiivisuuteen, jota havaitaan jopa 30%: lla näistä potilaista, vai KD:n ensisijaiseen vaikutukseen [3]. Tämä tekijä, joka voi olla ratkaiseva KD:n soveltamiselle muiden neurologisten häiriöiden hoitoon, kuin kuin vaikeasti hoidettava epilepsia [14].
Yhteenvetona voidaan todeta, että ketogeenisen ruokavalion pääasiallinen metabolinen vaikutus on aivojen energiansaannin turvaaminen vapailla rasvahapoilla. Niiden hajoaminen ketoaineiksi yhdessä PUFA-yhdisteiden lisääntymisen kanssa johtaa merkittäviin muutoksiin aineenvaihdunnan, bioenergian, mitokondrioiden ja jopa geenien toiminnassa. Näillä primaarisilla ja sekundaarisillä muutoksilla on kouristuksia estäviä ja neuroprotektiivisia vaikutuksia. KD on merkittävä osa lasten epileptologien terapiavaihtoehtoja. Onko ketogeeninen ruokavalio yhtä tehokas hoitoväline myös neurodegeneratiivisten tautien, kuten Parkinsonin ja Alzheimerin taudin hoidossa ja muissa patologioissa, kuten pahanlaatuisten kasvainten hoidossa? Tätä tutktitaan. Tulokset tämän artikkelin julkaisun (2011) jälkeen ovat olleet hyvin lupaavia.
Viitteet
- A. L. Hartman and E. P. G. Vining, “Clinical aspects of the ketogenic diet,” Epilepsia, vol. 48, no. 1, pp. 31–42, 2007. View at: Publisher Site | Google Scholar
- A. L. Hartman and J. M. Freeman, “Does the effectiveness of the ketogenic diet in different epilepsies yield insights into its mechanisms?” Epilepsia, vol. 49, supplement 8, pp. 53–56, 2008. View at: Publisher Site | Google Scholar
- K. W. Barañano and A. L. Hartman, “The ketogenic diet: uses in epilepsy and other neurologic illnesses,” Current Treatment Options in Neurology, vol. 10, no. 6, pp. 410–419, 2008. View at: Publisher Site | Google Scholar
- E. C. Wirrell, “Ketogenic ratio, calories, and fluids: do they matter?” Epilepsia, vol. 49, supplement 8, pp. 17–19, 2008. View at: Publisher Site | Google Scholar
- K. J. Bough and J. M. Rho, “Anticonvulsant mechanisms of the ketogenic diet,” Epilepsia, vol. 48, no. 1, pp. 43–58, 2007. View at: Publisher Site | Google Scholar
- S. A. Masino, M. Kawamura, C. A. Wasser, L. T. Pomeroy, and D. N. Ruskin, “Adenosine, ketogenic diet and epilepsy: the emerging therapeutic relationship between metabolism and brain activity,” Current Neuropharmacology, vol. 7, no. 3, pp. 257–268, 2009. View at: Publisher Site | Google Scholar
- N. Hasebe, K. Abe, E. Sugiyama, R. Hosoi, and O. Inoue, “Anticonvulsant effects of methyl ethyl ketone and diethyl ketone in several types of mouse seizure models,” European Journal of Pharmacology, vol. 642, pp. 66–71, 2010. View at: Publisher Site | Google Scholar
- D. B. Appleton and D. C. De Vivo, “An experimental animal model for the effect of ketogenic diet on epilepsy,” Proceedings of the Australian Association of Neurologists, vol. 10, pp. 75–80, 1973. View at: Google Scholar
- K. Bough, “Energy metabolism as part of the anticonvulsant mechanism of the ketogenic diet,” Epilepsia, vol. 49, supplement 8, pp. 91–93, 2008. View at: Publisher Site | Google Scholar
- B. T. Seyfried, M. Kiebish, J. Marsh, and P. Mukherjee, “Targeting energy metabolism in brain cancer through calorie restriction and the ketogenic diet,” Journal of Cancer Research and Therapeutics, vol. 5, supplement 1, pp. S7–15, 2009. View at: Google Scholar
- P. Stafford, M. G. Abdelwahab, D. Y. Kim, M. C. Preul, J. M. Rho, and A. C. Scheck, “The ketogenic diet reverses gene expression patterns and reduces reactive oxygen species levels when used as an adjuvant therapy for glioma,” Nutrition and Metabolism, vol. 7, article 74, 2010. View at: Publisher Site | Google Scholar
- L. C. Nebeling, F. Miraldi, S. B. Shurin, and E. Lerner, “Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports,” Journal of the American College of Nutrition, vol. 14, no. 2, pp. 202–208, 1995. View at: Google Scholar
- G. Zuccoli, N. Marcello, A. Pisanello et al., “Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: case report,” Nutrition & Metabolism, p. 33, 2010. View at: Publisher Site | Google Scholar
- J. H. Cross, A. Mclellan, E. G. Neal, S. Philip, E. Williams, and R. E. Williams, “The ketogenic diet in childhood epilepsy: where are we now?” Archives of Disease in Childhood, vol. 95, no. 7, pp. 550–553, 2010. View at: Publisher Site | Google Scholar
| Keren Politi, Lilach Shemer-Meiri, Avinoam Shuper, and S. Aharoni, Department of Pediatric and Adolescent Neurology, Schneider Children’s Medical Center of Israel, Faculty of Medicine, Tel Aviv University, Tel Aviv, IsraelCopyright © 2011 Keren Politi et al. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. |