Neurodegeneraation ja aksonaalisten vaurioiden mekanismit progressiivisessa multippeliskleroosissa 1
Sairastan ensisijaisesti etenevää multippeliskleroosia, johon ei tunneta hidastavaa, tai parantavaa lääkitystä. Primaaristi progressiivinen MS-tauti tunnetaan edelleen heikommin, kuin selvästi yleisempi aaltoilevasti etenevä relapsoiva-remittoiva MS.
Usein MS-taudista puhuttaessa unohdetaan, että relapsoiva-remittoiva MS-tauti ja primaaristi progressiivinen MS-tauti eroavat taudin etenemisen suhteen merkittävästi toisistaan. Tautimuodot ovat luonteiltaan kuin kesä ja talvi.
Yritän parhaani mukaan levittää tietoa PPMS-taudin syistä ja vaikutusmekanismeista. Etsin myös aktiivisesti tietoa keinoista, jolla taudin neurodegeneratiivista etenemistä voisi hidastaa.
En usko, että monitekijäisiin ongelmiin on yksinkertaisia tai helppoja vastauksia
Tämäkin on pitkä ja vaikeatajuinen aineenvaihduntaa ja biokemiaa sivuava kirjoitus, jonka sisäistäminen vie aikaa. Tämä on toistaiseksi täsmällisin selvitys etenevän MS-taudin patogeneesista, jonka olen lukenut. Jaan artikkelin kahteen osaan, joista tämä on ensimmäinen.
Avaan tässä Jorge Correalen, Mariano Marrodanin ja María Célica Ysrraelitin laatimaa tutkimuskatsausta: Mechanisms of Neurodegeneration and Axonal Dysfunction in Progressive Multiple Sclerosis
Progressiivinen multippeliskleroosi on monitekijäinen neurologinen sairaus, joka vaurioittaa aivojen kortikaalisten alueiden ja harmaan aineen soluja
Taudille tyypillinen oireiden asteittainen paheneminen johtuu erilaisista mekanismeista ja keskushermostoon rajoittuneista immuunireaktioista, kuten:
- B-solujen dysregulaatio (eli B-solujen säätelyvirhe)
- CD8+ T-solut, jotka aiheuttavat demyelinaation ja/tai aksonaaliset / hermosolujen vauriot
- aivokuoren demyelinoivissa vaurioissa havaittu neuriittiseen transaktioon liittyvä mikrogliaalinen soluaktivaatio
Muita mahdollisia neurodegeneraation aiheuttajia ovat reaktiivisten happi- ja typpiradikaalien muodostuminen ja solujen energiantuotantoa heikentävät mitokondrioiden vauriot.
Ca2+:n kertyminen aksoneihin lisää solujen rappeutumista aktivoimalla eräitä katabolisia entsyymeitä, mikä johtaa sytoskeletoniproteiinien, eli solun tukirangan proteiinien progressiiviseen proteolyyttiseen hajoamiseen.
Oligodendrosyyttien aksoneille tuottaman energian väheneminen johtaa aksonien rappeutumiseen ja siten hermosolujen vaurioitumiseen ja tuhoutumiseen. Nämä mekanismit eivät poissulje toisiaan.
Neurodegeneraation ja aksonaalisten vaurioiden mekanismit progressiivisessa multippeliskleroosissa
Käsitteitä
Aksoni (viejähaarake eli hermosyy) on hermosolun (neuronin) osa, joita on vain yksi neuronia kohti, kun taas tuojahaarakkeita (dendriittejä) on useita yhdessä neuronissa.
Aksoni haarautuu loppupäästään ja muodostaa useita hermopäätteitä, jotka voivat muodostaa synapsin toisen hermosolun tai lihassolun kanssa. Aksoni voi olla joko myelinisoitunut tai myelinisoitumaton. Myelinisoituneessa aksonissa hermoimpulssi kulkee nopeammin kuin myelinisoitumattomassa,
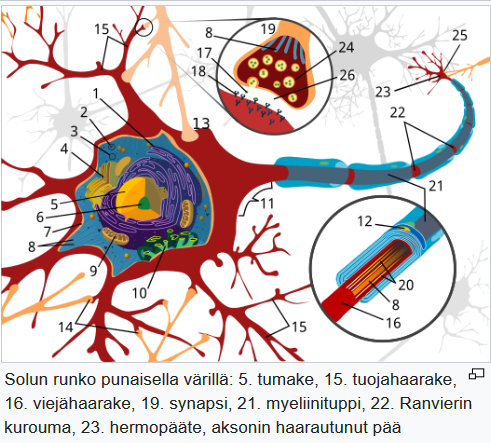
Gliasolut (hermotukisolut) ovat hermotukikudoksen (neuroglian) muodostavia soluja. Niitä on hermokudoksessa enemmän kuin hermosoluja eli neuroneja. Aivoissa on gliasoluja ehkä noin kolme kertaa niin paljon kuin hermosoluja.
Oligodendrosyytit muodostavat keskushermoston aksoneiden myeliinitupet, eli ne ovat samankaltaisia ääreishermoston Schwannin solujen kanssa. Oligodendrosyytit voivat osallistua usean hermosyyn myelinisaatioon.
Astrosyyttien tärkein tehtävä on pitää huolta hermosolujen kemiallisesta tasapainosta. Niiden perivaskulaariset ulokkeet ovat kosketuksissa keskushermoston hiussuonien endoteelisolujen kanssa, ja niin astrosyytit osallistuvat veri-aivoesteen muodostamiseen.
Astrosyytin ulokkeista osa on siis kosketuksissa hiussuoniin, osa hermosoluihin, ja näin ne huolehtivat hermosolujen ravinto- ja kuona-aineiden siirtämisestä.
Astrosyyttejä on muodoltaan kahdenlaisia: säikeisiä (etenkin valkeassa aineessa) ja protoplasmisia (etenkin harmaassa aineessa). Jotkin astrosyyteistä saattavat olla hermokudoksen kantasoluja.
Mikrogliasolut poistavat hermokudoksesta solujätettä eli toimivat kuin makrofagit; jotkut neurobiologit katsovat niiden olevan makrofagien alatyyppi.
Mikrogliasolut myös erittävät viestiaineita, etenkin sytokiineja, jotka liittyvät paikalliseen tulehdusreaktioon.
Leesioilla tarkoitetaan vammaa, vauriota, vioittumaa, häiriötä tms; elimen rakenteen tai toiminnan sairaalloista muutosta
Aivot ja selkäydin
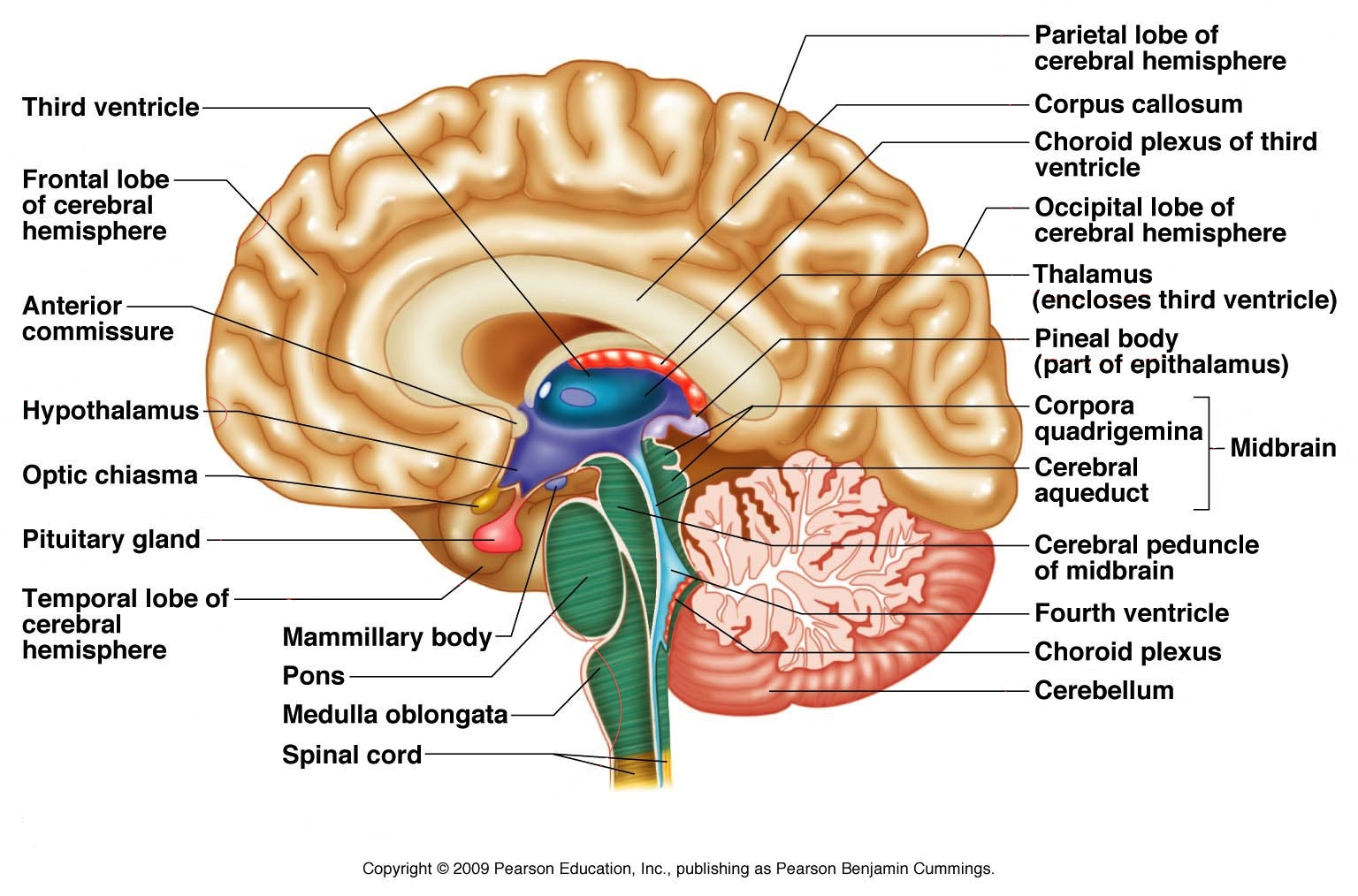
Tässä katsauksessa sukelletaan syvälle aivoihin ja aivojen kemiallisiin tapahtumiin.
Multippeliskleroosi on aivoihin ja selkäytimeen vaikuttava neurologinen sairaus, jonka oireita on helpompi ymmärtää dissektoimalla aivot erilaisiin toiminnallisiin segmentteihin.
Keskushermostoon kuuluvat isot aivot, pikkuaivot, aivorunko ja selkäydin. Keskushermosto saa informaatiota ääreis- eli perifeerisestä hermostosta. Aivojen signaalit lihaksille ja umpieritysrauhasille välittyvät myös ääreishermoja pitkin.
Tietoisuus ja tahdosta riippuvainen toiminta on keskittynyt isoihin aivoihin. Pikkuaivot orkestroivat tahdosta riippumattomia toimintoja tai toteuttavat isojen aivojen käskyjä. Pikkuaivoilla on tärkeä rooli motorisen muistin hallinnassa ja opittujen liikeratojen suorittamisessa. Pikkuaivot liittyvät aivorungon takaosaan pikkuaivovarsien (pedunculus cerebelli) välityksellä.
Aivorunko sisältää motorisia ja sensorisia hermoratoja sekä yhteyksiä aivojen eri osien välillä. Aivorungossa on myös paljon hermosolurykelmiä, eli tumakkeita, jotka säätelevät tiedostamattomia elintoimintoja, kuten hengitystä.
Ylhäältä katsoen aivorunko muodostuu väliaivoista (diencephalon), keskiaivoista (mesencephalon), aivosillasta (pons) ja ydinjatkoksesta (medulla oblongata). Väliaivoissa on hormonitoimintaa säätelevä hypotalamus sekä talamus, jonka solujen kautta aistien lähettämät signaalit hajua paitsi, välittyvät aivokuorelle.
Selkäydin sisältää ensisijaisesti lihasten ohjaamiseen ja tuntoaistimusten välittämiseen liittyviä hermoratoja. Toisaalta selkäytimen neuronit hallitsevat eräitä automaattisia reflektireaktioita ja ohjaavat eräitä automaattisia toimintoja, kuten kävelyn säätelyä.
Aivot kelluvat aivo-selkäydinnesteessä (cerebrospinal fluid / CSF), joka suojaa aivojen herkkiä rakenteita fyysisenä ja kemiallisena puskurina. CSF suojaa aivoja mm. iskuilta.
Kaksi aivopuoliskoa (hemispheres) käsittävät isot aivot koostuvat aivokuoresta (cortex), valkeasta aineesta harmaan sisäpuolella sekä tyvitumakkeista (basal ganglia). Basaaligangliat ovat hermosolujen kasaumia, joilla on yhteyksiä liikettä ohjaaviin aivokuoren alueisiin sekä pikkuaivoihin.
Valkea aine koostuu lähinnä aivoon tulevista ja aivoista lähtevistä sekä aivokuoren eri osien välisistä aksonikimpuista (viejähaarakekimpuista), joiden myeliinitupit antavat valkealle aineelle värin.
Aivokuori jaetaan neljään lohkoon kummallakin aivopuoliskolla. Etummaisena on otsalohko (lobus frontalis). Sen takana on päälaenlohko (lobus parietalis). Näiden väliin jäävä uurre on keskusvako (sulcus centralis). Sivuvaon (sulcus Sylvii) alapuolella on ohimolohko (lobus temporalis). Takaraivolohko (lobus occipitalis) on aivojen takaosassa.
Aivokuori näyttää pinnallisesti tarkasteltuna melko samanlaiselta kaikkialta, mutta solutyyppien jakauman, aivokuoren kerrosrakenteen, metabolian, yhteyksien sekä toiminnallisten erojen vuoksi kukin lohko on jaettu lukuisiin aivoalueisiin. Ensimmäinen systemaattinen jako oli histologinen: saksalainen Brodmann numeroi aivoalueet siinä järjestyksessä kun hän uusia kudosrakenteita löysi.
Aivokuoren sytoarkkitehtoniset alueet Brodmannin mukaan. Tärkeimmät alueet ovat motorinen aivokuori (alue 4), tuntoaivokuori (1,2 ja 3), näköaivokuori (17,18 ja 19) sekä kuuloaivokuori (41 ja 42). Muut alueet muodostavat ihmisen aivoissa erityisen laajoiksi kehittyneet assosiatiiviset osat.
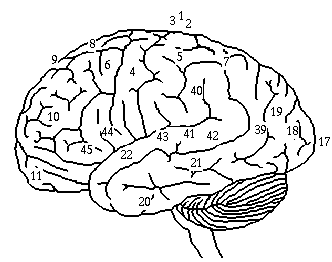
Aivokuoren eri alueet ja aivoalueiden osat ovat kytkeytyneet toisiinsa assosiaatiosyiksi kutsuttujen valkean aineen aksonikimppujen välityksellä. Aivopuoliskojen välisiä yhteyksiä kutsutaan kommissuraalisyiksi. Kommissuraalisyiden pari miljoonaa aksonia muodostaa aivokurkiaisen (corpus callosum), joka on suurin aivopuoliskojen välinen tiedonsiirtoväylä.
Aisteista tulevat (afferentit) signaalit (hajua lukuunottamatta) välittyvät talamuksen kautta; talamuksen ja korteksin yhteydet ovat kaksisuuntaiset, ts. aivokuorelta on voimakas takaisinkytkentä talamukseen.
Suurin hermosäiekimppu talamuksesta aivokuorelle on optinen radiaatio (optic radiation) ulommasta polvitumakkeesta näköaivokuorelle. Motoriset (efferentit) viestit taas vällittyvät pitkin capsula internaa aivokuorelta aivorunkoon. Tämä vahva hermosäiekimppu menee talamuksen ja tyvitumakkeiden välistä.
Keskushermosto on sekä vasemmalta että oikealta puoleltaan yhteydessä ulkomaailmaan 12 aivohermon (cranial nerves) ja 31 selkäydinhermon (spinal nerves) kautta. Aivohermot ovat yhteydessä pään seudun aisteihin ja lihaksiin.
Selkäydinhermot palvelevat muuta osaa kehosta. Niiden kautta saapuvat afferentit hermoradat menevät ensin talamukseen ja sieltä aivokuorelle. Selänpuoleiset hermoradat (dorsal columns) vievät selkäytimen yläpäässä oleviin tumakkeisiin, joista signaalit etenevät lemniscus medialista pitkin talamuksen vastakkaiseen puoliskoon ja sieltä edelleen tuntoaivokuorelle (alueet 1, 2 ja 3).
Pikkuaivot koostuvat kahdesta voimakkaasti poimuttuneesta puoliskosta. Pikkuaivokuoren (cortex cerebelli) sisäpuolella on myelinisoitujen aksonien muodostamaa valkeaa ainetta. Pikkuaivokuori on kauttaaltaan samanlainen, joten sen eri alueet luultavasti käsittelevät saamansa tiedon samalla tavalla.
Pikkuaivot säätelevät lihasliikkeitä ja liikesarjoja (esim. polkupyörällä ajo) ja liikkeiden ajoitusta yhdessä tyvitumakkeiden ja liikeaivokuoren kanssa. Ne ovat tärkeät myös tasapainon säilymisen kannalta. Keskushermostoa ympäröi tiivis kalvosto.
Aivokalvojen ja hermokudoksen välissä on aivoselkäydinnestettä (cerebrospinal fluid = CSF, liquor cerebrospinalis), jota valmistuu aivokammioiden seinämissä . Aivot kelluvat tässä nesteessä ja neste muodostaa hermosoluille optimaalisen toimintaympäristön, jota aktiiviset mekanismit pyrkivät pitämään vakaana.
Veri saapuu aivoihin molemminpuolisia kaulavaltimoita (carotid artery, arteria carotis) ja niskassa kulkevia nikamavaltimoita (vertebral artery, a. vertebralis) pitkin. Nämä neljä valtimoa muodostavat aivojen pohjassa verisuonirenkaan (circle of Willis, circulus Willisii 1500-luvulla eläneen brittianatomin mukaan), josta nousee molemmin puolin kolme aivojen päävaltimoa (a. cerebri anterior, a. cerebri media ja a. cerebri posterior).
Mikäli kaula- tai nikamavaltimo ahtautuu hitaasti, elimistö pystyy yleensä korvaamaan aivojen verenpuutteen tämän suonirenkaan avulla; äkillinen tukos aiheuttaa kuitenkin ainakin ohimeneviä oireita.
Kun kudosta aivovaltimoiden tukkeutuessa hapenpuutteen takia vaurioituu, puhutaan aivoinfarktista tai ohimenevästä aivoverenkiertohäiriöstä (TIA). Verisuonen katketessa taas syntyy aivoverenvuoto joko aivojen sisään (intrakerebraalivuoto) tai lukinkalvon alle (subaraknoidaalivuoto). Vuodon tai infarktin paikka ja laajuus ratkaisevat, minkälaisia oireita potilaalla on.
Pahimmassa tapauksessa aivoinfarkti johtaa nopeaan kuolemaan. Aivojen laskimot (sinukset) kulkevat lähellä kalloa ja veri palaa niistä yläonttolaskimon kautta sydämeen.
Lähde: Aivojen rakenne ja toiminta, Risto Ilmoniemi, Helsingin yliopistollinen keskussairaala

Johdanto
Multippeliskleroosi (MS) on keskushermoston (CNS) krooninen tulehdussairaus, joka aiheuttaa vaurioita aivojen ja selkäytimen valkeassa ja harmaassa aineessa.
Viejähaarakkeita suojaavien myeliinituppien vaurioitumisen (demyelinaation) lisäksi keskushermostossa tapahtuu neurodegeneraatiota, joka johtaa hermosolujen surkastumiseen, rappeutumiseen ja kuoleman.
MS-taudin etiologia tunnetaan yhä huonosti, mutta immunologisten, geneettisten ja histopatologisten tutkimusten perusteella uskotaan, että MS-taudin patogeneesissä autoimmuniteetilla on keskeinen rooli.
Taudin kulku voi vaihdella potilaskohtaisesti, mutta useimmilla potilailla esiintyy toistuvia kliinisiä oireita taudin alusta alkaen, minkä jälkeen tapahtuu täydellinen tai osittainen oireista toipuminen. Tämä tautimuoto on aaltoilevasti etenevä, eli relapsoiva-remittoiva MS (RRMS).
10–15 vuoden jälkeen RRMS muuttuu eteneväksi (progressiiviseksi) jopa 50%:lla potilaista. Toissijaisesti etenevässä MS-taudissa (SPMS) oireet etenevät yleensä hitaasti ilman pahenemis- tai paranemisvaiheita monen vuoden ajan.
15 prosentilla MS-potilaista eireet etenevät taudin alusta alkaen tasaisesti ilman pahenemis- ja paranemisvaiheita. Tämä on ensisijaiseksi etenevä, eli primaaristi progressiivinen MS-tauti (PPMS).
Nykyään ei olla aivan varmoja siitä, onko PPMS erillinen MS-taudin muoto vai ilman tunnistettavia kliinisiä relapseja sekundaarisesti eteneväksi muuttunut MS.
Tämä on ihan uskottava hypoteesi. Minä koin kaksoiskuvia ja tasapainovaikeuksia aiheuttaneen kohtauksen vuosia ennen MS-diagnoosia. Sen syy ei koskaanselvinnyt, mutta jälkikäteen ajatellen kohtaus saattoi olla ensimmäinen ja ainoa MS-taudin pahenemisvaihe. Oireet kestivät useita päiviä.
Toisaalta monet MS-tautiin viittaavat oireet olivat minulla alkaneet lievinä jo vuosituhannen vaihteen molemmin puolin.
Sellaisenkin hypoteesin olen lukenut, jossa PPMS luokitellaan omaksi sairaudekseen, joka yhtäläisyyksistä huolimatta ei varsinaisesti ole inflammatorinen autoimmuunitauti, kuten MS-tauti, vaan lähempänä muita neurodegeneratiivisia sairauksia, kuten Parkinsonin tautia.
Multippeliskleroosin tyypillisin aivokudosvaurio on aksoneita suojaavien myeliinituppien primaarinen demyelinaatio aivojen valkeassa aineessa. Myeliinin vauriot altistavat myös hermosyyt vaurioille.
RRMS:sä aktiivisesti demyelinoiviin plakkeihin liittyy immuunisolujen pääsy ääreisalueelta keskushermostoon, mikä selittyy veri-aivoesteen (BBB) vuotamisella.
Terveen veri-aivoesteen ei pitäisi päästää perifeerisiä immuunisoluja keskushermostoon.
Progressiivisessa MS-taudissa patologisia prosesseja aivoissa välittävät pääasiassa paikalliset keskushermostosolut. Magneettikuvantamisella (MRI) on osoitettu, että PPMS:ssä keskushermoston vauriossa esiintyy vähäisempiä gadolinium-pitoisuuksia, mikä viittaa siihen, että leesiot eivät ole immuunijärjestelmän aiheuttamia.
Useat kudospatologiset havainnot liittyvät progressiiviseen MS: ään. Tärkein on aivojen atrofia, eli rappeuma tai surkastuminen, jonka aiheuttaa pääasiassa aksonien krooninen demyelinaatio, mikä johtaa lopulta hermosolujen menetykseen.
Vaikka MRI-kuvantaminen ja neuropatologiset tutkimukset ovat osoittaneet, että sekä aksonin rappeutumista että hermosolujen kuolemaa esiintyy akuuteissa ja aktiivisissa MS-vaurioissa, taudin eteneminen tapahtuu todennäköisesti, kun aksonituho ylittää keskushermoston kompensointikyvyn.

Ovatko tulehdus ja hermoston rappeutuminen ensisijaisia vai toissijaisia prosesseja ja miten ne ovat vuorovaikutuksessa taudin aikana, on edelleen epäselvää
Toinen progressiivisen MS:n merkittävä patologinen substraatti on kortikaalinen demyelinaatio. Harmaan aineen demyelinaatiota havaitaan myös pikkuaivokuoressa, hippokampuksessa ja syvän harmaan aineen solujen tumisa.
Demyelinoitumisen ja oligodendrosyyttien häviämisen lisäksi demyelinoivissa aivokuoren vaurioissa esiintyy hermosolujen transaktiota, hermosolujen kuolemaa ja pienentyneitä presynaptisia terminaalilukuja.
Progressiivisissa MS-vaurioissa diffuusia patologiaa esiintyy myös terveeltä vaikuttavassa valkeassa ja harmaassa aineessa, mikä heijastuu diffuuseina (epätarkkarajaisina) aksonivaurioina, joissa syvä mikroglia-aktivaatio vaikuttaa aivokalvon laajan tulehdusreaktion taustalla.
MRI-tutkimukset viittaavat siihen, että aivokuoren atrofia (surkastuminen) voi olla läheisemmässä suhteessa diffuusiin hermoston rappeutumiseen terveeltä näyttävässä valkeassa aineessa kuin fokaaliseen (pesäkkeisiin liittyvän) valkean aineen demyelinaation laajuudessa.
Tässä katsauksessa käsitellään nykyistä käsitystä harmaan aineen tapahtumista progressiivisen MS-taudin patogeneesissa sekä oletettuja mekanismeja, jotka voivat selittää hermoston rappeutumista ja hermosolujen kuolemaa.
MS-taudissa havaitut harmaan aineen muutokset
MS-taudin uskottiin pitkään olevan tulehduksen välittämä keskushermoston valkean aineen demyelinoiva sairaus, mutta viime vuosina on noussut esiin mahdollisuus, että aivokuoren ja syvän harmaan aineen demyelinaatio voivat olla valkean aineen vaurioita merkittävämpiä taudin oireita ja etenemistä selittäviä syitä.
Valkean aineen demyelinaation ruumiinavaus- ja in vivo tutkimukset ovat paljastaneet laajojen vaurioiden esiintymisen harmaata ainetta tukevissa rakenteissa.
Aluksi tämä selitettiin harvinaisena geneettisenä poikkeamana, joka liittyy yksinomaan taudin pitkittyneeseen kestoon ja eteneviin muotoihin.
Äskettäin osoitettiin, että kortikaalisia ja syvän harmaan aineen vaurioita talamuksessa, häntätumakkeessa, tyvitumakkeessa ja pikkuaivokuoressa esiintyy jo taudin alkuvaiheessa riippumatta valkean aineen patologiasta.
Todisteet taudin aktiivisuuteen ja aggressiivisempiin muotoihin liittyvistä harmaan aineen vaurioista lisääntyvät jatkuvasti
Toisin kuin muissa neurodegeneratiivisissa sairauksissa, ei tiedetä, onko aivokuoren atrofia MS:ssä diffuusi prosessi vai kehittyykö atrofia sen sijaan yksilöllisten anatomisten mallien mukaisesti.
Otsalohkon kortikaaliset osat, pihtipoimun takaosat, aivosaareke ja ohimolohkojen (erityisesti hippokampuksen) ja pikkuaivojen aivokuoren alueet ovat aivoalueita, joihin progressiivinen tauti iskee jo taudin varhaisessa vaiheessa. Tämä selittää ivaliditeetin etenemisen ja tautiin usein liittyvät lievät ja keskivaikeat kognitiiviset oireet.
Pitkään MS-tautia sairastaneilla on viime aikoina kuvattu erilaisia kortikaalisen atrofian tapahtumia, joissa on tai ei ole samanaikaisia valkean aineen vaurioita.
Suurin osa saadusta näytöstä viittaa vaurioiden symmetriseen (ei-satunnaiseen) jakautumiseen. Vaurioilla on vahva yhteys kliinisiin oireisiin.
Ruumiinavauksissa saaduista keskushermostokudosnäytteistä on havaittu erilaisia aivokuoren vaurioita noin 60 prosentissa tapauksista, kun taas uudemmissa 7T-magneettikuvausprotokollissa esiintyvyyden arvioidaan olevan yli 90%.
MS-potilaiden aivokudoksessa on raportoitu kolmen tyyppisiä kortikaalisia vaurioita: leukokortikaalisia, intrakortikaalisia ja subpiaalisia
Leukokortikaaliset leesiot (tyypin 1 leesiot) näyttävät alkavan aivokuoren alapuolisesta valkeasta aineesta ja ulottuvan aivokuoreen kerroksiin V ja VI. Näiden vaurioiden aivokuorisektorit osoittivat lisääntynyttä lymfosyyttien ja mikroglia- / monosyyttien määrää verrattuna terveeseen aivokuoreen samasta aivosta tai ikääntyneistä vertailuaivoista, vaikka näiden solujen lukumäärä on huomattavasti vähäisempi kuin aivokuoren alapuolisessa valkeassa ainessa. Leukokortikaalisia vaurioita on havaittu potilailla jopa taudin varhaisimmissa vaiheissa.
Intrakortikaaliset, eli aivokuoren sisäiset leesiot (tyypin 2 leesiot) sijaitsevat kokonaan aivokuoressa, eivätkä ole suorassa kosketuksessa aivokuoren valkean aineen tai pehmytkudoksen (pia mater) kanssa. Nämä vauriot ovat yleensä pieniä ja perivaskulaarisia (verisuonia ympäröiviä).
Subpiaaliset leesiot (tyypin 3 leesiot) edustavat kaikkein runsainta kortikaalivaurioiden tyyppiä ja ovat merkittävimpiä vaurioita MS-taudin progressiivisissa muodoissa. Nähin vaurioihin liittyy usein myeliinin menetystä kortikaalisissa kerroksissa I – IV, jotka ulottuvat useisiin aivopoimuihin (gyri, gyrus).
Joskus ne voivat läpäistä kaikki kuusi aivokuorikerrosta, mutta harvoin vauriot tunkeutuvat subkortikaaliseen valkoiseen aineeseen.
Oireisiin voi liittyä tulehdusreaktio aivokalvolla. Myeliinivaurioita paitsi, subpiaalisissa leesioissa ei ole suurinta osaa muista patologisista ominaispiirteistä, joita kuvataan valkean aineen vaurioissa, kuten veri-aivoesteen vuotaminen, immuunisolujen tunkeutuminen keskushermostoon, perivaskulaariset muutokset (perivascular cuffs, jossa inflammaatioon viittaavia leukosyyttejä kumuloituu verisuonten ympärille), astroglioosi tai oligodendrosyyttien esisolujen tuhoutuminen.
Aktiivinen kudosvaurio liittyy myös mikroglia-aktivaatioon. Korrelaatiota subpiaalisen ja valkean aineen leesioiden kuormitusten välillä ei ole havaittu, mikä viittaa siihen, että subpiaalinen demyelinaatio tapahtuu riippumatta valkean aineen demyelinaatiosta.
Ruumiinavaustutkimusten yleinen konsensus on, että subpiaalisia vaurioita esiintyy runsaasti MS:n progressiivisissa tautimuodoissa ( PPMS ja SPMS), mutta ne ovat harvinaisia MS-potilailla, joilla on akuutti MS tai RRMS.
Syvän harmaan aineen (DGM) rakenteiden muutokset MS-taudissa
DGM-rakenteiden muutoksia multippeliskleroosissa on tutkittu melko vähän.Kortikaalista atrofiaa havaitaan usein syvässä harmaassa aineessa, etenkin talamuksessa.
On yhä enemmän todisteita siitä, että harmaan aineen volyymin väheneminen (neurodegeneraatio) on invaliditeetin etenemisen kannalta tärkeämpi vaikuttaja, kuin demyelinaatio ja valkean aineen vauriot.
Talamus saattaa olla erityisen herkkä hermoston rappeutumiselle. Demyelinoivia vaurioita voi esiintyä talamuksessa ja peritalaamisilla alueilla.
DGM:n demyelinaatiota löydetään usein MS-tautia sairastaneiden ruumiinavauksissa. Kuolemanjälkeisissä tutkimuksissa demyelinaatiota havaitaan erityisesti häntätumakkeessa sekä talamuksen mediaalisissa ja anteriorisissa tumakkeissa.
Talamuksessa havaittavien vaurioiden histopatologinen* hahmottelu kokoaa yhteen aktiivisen, kroonisesti demyelinoivan, valkeassa aineessa havaittujen vaurioiden spektrin.
* histopatologiassa tutkitaan, onko kudosnäytteissä tulehdukseen, kasvaimiin, rappeumaan tai syöpään viittaavia muutoksia
Samoin kuin ruumiinavauksessa todetut muutokset aivokuoren harmaassa aineessa, T- ja B-solujen aiheuttama parenkymaalinen tunkeutuminen on rajallista verrattuna klassisten aktiivisten valkean aineen vaurioiden havaittuihin tasoihin.
Tutkimus on osoittanut MS-potilailla selkeitä surkastumia harmaan aineen volyymissa
Surkastumat keskittyvät alueille, jotka ovat vahvasti yhteydessä erilaisiin hermosoluihin.
Koska DGM-rakenteet ovat laajasti yhteydessä kortikaalikehän harmaan aineen alueisiin, atrofia voi johtua myös taaksepäin kulkevasta tapahtumaketjusta, joka aiheutuu aksonitransaktiosta talamuksesta ulkonevissa valkean aineen rakenteissa tai sekundaarisesti talamushermosolujen trans-synaptisesta deafferentaatiosta*.
*keskushermostoon tuovien hermoimpulssien kulun estyminen esim. katkenneissa hermoissa
Tutkimukset ovat osoittaneet, että syvän harmaan aineen volyymin surkastuminen on ajan myötä nopeampaa kuin muilla aivojen alueilla kaikissa kliinisissä MS-fenotyypeissä, ja se johtaa invaliditeetin etenemiseen.
Yhdessä nämä tutkimukset tarjoavat vahvaa näyttöä siitä, että talamuksen ja DGM:n volyymiin surkastuminen vaikuttaa dramaattisesti taudin vaikeusasteeseen.
Tulehduksia lievittävät sekä immuunijärjestelmän toimintaa säätelevät lääkkeet toimivat yleensä hyvin aaltomaisesti etenevässä RRMS-tautimuodossa, mutta niillä ei ole terapeuttista arvoa progresiivisissa tautimuodoisssa.
Lääkkeet eivät hidasta MS-taudin etenemistä, vaikka ne lievittävät ja estävät RRMS-taudin akuutteja pahenemisvaiheita. Pitkällä aikahaitarilla eri MS-tautimuotojen invalidisaation aste ja kliiniset oireet lähestyvät toisiaan. Tämä viittaa siihen, että neurodeneraation hidastamiseen tähtäävä terapia olisi taudin alusta alkaen perusteltua.
Ilmeisesti vain neurodegeneraation ehkäisemisellä ja hidastamisella voi vaikuttaa myönteisesti taudin etenemiseen pitkällä aikavälillä.
Lisääntyvä kliininen näyttö osoittaa, että toistaiseksi paras tapa hidastaa/estää neurodegeneraatiota on ketoosiin perustuva aineenvaihdunta, sillä aivorappeumaa ja solujen kuolemaa aiheuttaa erityisesti aivosolujen glukoosinottoon liittyvä trofistinen häiriö.
Kun aivosolut eivät saa energiaa glukoosista, ne kuolevat energianpuutteeseen. Onneksi aivosolut saavat tarvitsemansa energian vaihtoehtoisesti myös ketoaineista, kuten betahydroksibutyraatista.
MRI-kuvantaminen ja kognitiiviset testit osoittavat, että ketoosissa aivojen aktiivisuus ja soluterveys paranevat. Käsittelin aihetta aiemmin pitkässä tutkimuskatsauksessa.
Neurodegeneraation mekanismit
Etenevän MS-taudin syistä on esitetty erilaisia valituneita arvauksia. Eräs ehdotus on, että vaikka aivovaurioita ohjaavat tulehdusprosessit ovat verrannollisia aaltoilevasti etenevän MS-taudin tulehdusprosessien kanssa, progressiivisesti etenevässä taudissa keskushermostoon kehittyy tulehdussoluja suosiva mikroympäristö, mikä tekee immunomodifioivista hoidoista tehottomia.
Toinen mahdollisuus on, että MS alkaa tulehduksellisena sairautena, mutta useiden vuosien jälkeen tulehdusvasteista riippumaton neurodegeneratiivinen prosessi muuttuu taudin etenemisessä keskeiseksi mekanismiksi.
MS voi olla neurodegeneratiivinen sairaus, jossa tulehdus esiintyy toissijaisena tauden etenemistä vahvistavana vasteena.
Nämä erilaiset mekanismit eivät sulje pois toisiaan ja voivat esiintyä yhdessä. Siksi MS-taudissa neurodegeneraatio ja lopulta taudin eteneminen sekä krooniset vauriot kehittyvät monien erilaisten molekyylimekanismien seurauksena. Näistä on esitetty yhteenveto, jota en käännä:
Multippeliskleroosin etenemistä selittävät mekanismit
|
Immunological Mechanisms and Effectors |
Mechanisms of Neurodegeneration and Axonal Dysfunction |
|---|---|
|
B Cells |
Mitochondrial Injury |
|
Antibody production, Ag presentation, ectopic formation of follicle-like structures |
Impaired activity of respiratory chain complexes (I, III and IV) |
|
CD8+ cytotoxic T lymphocytes |
Release of Fe3+ |
|
Release of TNF-α: neuronal cell death via p55 receptor; IFN-γ: increased Glutamate neurotoxicity and Ca2+ influx; secretion of perforin and granzyme: cellular membrane damage, associated to Na+ and Ca2+ influx |
Iron accumulates with aging. The release of Fe3+ from damaged OGD amplifies oxidative injury |
|
Astrocytes * |
Anomalous Distribution of Ion Channels |
|
Secretion of pro-inflammatory cytokines (IL-1, IL-6, TNF-α), chemokines (CCL-2, CCL-5, IP-10, CXCL-12, IL-8) and BAFF. |
Redistribution of Na+ channels (Nav, 1.2, 1.6 and 1.8) along the denuded axon: increased energy demand. |
|
Microglia * |
Loss of Myelin-Derived Trophic Support and Deficit in Axonal Transport |
|
Decreased expression of immunosuppressive factors: fractalkine-CX3CR1, and CD200-CD200R. Secretion of pro-inflammatory cytokines: IL-1, IL-6, TNF-α, IFN-γ. Ag presentation of CD4+ T cells via Major Histocompatibility Complex (MHC) Class II |
Alteration of a single myelin protein synthesis (PLP, MGA, or CNP) can cause axonal dysfunction |
*Taulukossa esiintyvät lyhennykset:
Ag: antigeeni
AGE: Edistyneet glykaation lopputuotteet
ASIC1: happoa tunnistava ionikanava
BAFF: B-solua aktivoiva tekijä
CNP: 2’3′-syklinen nukleotidi 3′-fosfodiesteraasi
CNS: keskushermosto
CSPG:t: kondroitiinisulfaatti-proteoglykaanit
EBV: Epstein – Barr-virus
EPH: efriinit
FGF-2: fibroblastien kasvutekijä 2
GM-CSF: granulosyytti-makrofagipesäkkeitä stimuloiva tekijä
MAG: myeliiniin liittyvä glykoproteiini
M-CSF: makrofagipesäkkeitä stimuloiva tekijä
mtDNA: mitokondrioiden DNA
NCX: natriumkalsiumvaihdin
NO: typpioksidi
OGD: oligodendrosyytit
ONOO -: peroksinitriitti
PLP: proteolipidiproteiini
RAGE: AGE-reseptori
RNS: reaktiiviset typpilajit
ROS: reaktiiviset happilajit
TRPM4: ohimenevä potentiaalireseptori melastatiini 4
VGCC: Jänniteohjattu Ca2 + -kanava.
Tulehdukselliset tapahtumat
Eläinmalleista ja MS-potilailla tehdyistä immunologisista tutkimuksista saatu näyttö viittaa siihen, että keskushermostoon kohdistuva perifeerinen immuunivaste ohjaa sairausprosessia varhaisvaiheissa, kun taas keskushermostoon rajoittuneet immuunireaktiot hallitsevat taudin etenemisen myöhempiä vaiheita.
Tulehduksellisen infiltraatin (keräymä, tiivistymä) koostumus keskushermostossa johtuu perifeeristen immuunisolujen sisäänvirtauksen ja erityisesti mikrogliaalisten solujen aktivoitumisen yhdistelmästä, joka voi muuttaa niiden sisäistä ”lepotilaa” vasteena pitkittyneelle tulehdukselle.
Etenevässä MS-taudissa tulehdusta aiheuttavien ehdokkaiden joukossa B-solujen rooli näyttää olevan hyvin merkittävä. B-solutoimintoja, joilla voi olla merkitystä etenevässä MS-taudissa ovat:
- vasta-ainetuotanto
- tulehdusta edistävien sytokiinien lisääntynyt eritys
- puutteellinen komplementtijärjestelmän aktivaatioon ja T-solujen toimintaan vaikuttava säätelysytokiinien tuotanto
- antigeenien esittely ja follikkelien kaltaisten rakenteiden virhesijaintinen, eli ektooppinen muodostuminen.
Ektooppiset munarakkulamaiset rakenteet ovat patologisia kudosmuodostumia, jotka muistuttavat tertiäärisiä imusolmukkeita, ja jotka löytyvät leptomeningien* subaraknoidisesta (lukinkalvon alaisesta?) tilasta lähellä tulehtuneita verisuonia ja joita esiintyy myös muissa kroonisissa tulehdussairauksissa. Nämä voidaan indusoida follikulaaristen T-auttajasolujen sytokiiniverkostoilla, jotka toimivat positiivisina (so. IL-21 ja IL-22) ja negatiivisina (eli IL-27) säätelijöinä, samoin kuin muutoksilla stroomassa (sidekudosverkossa).
*Leptomeningit: Kaksi sisintä kudoskerrosta, jotka peittävät aivot ja selkäytimen. Näitä kahta kerrosta kutsutaan arachnoid materiksi ja pia materiksi
Näiden patologisten rakenteiden koostumukselle on tunnusomaista T- ja B-solujen aggregaatit, jotka usein osoittavat T-/B-segregoitumista
Ne kykenevät ylläpitämään vasta-aineiden monipuolistumista in situ, isotyyppien vaihtamista, B-solujen erilaistumista ja oligoklonaalista leviämistä, jotka muistuttavat ektooppisia itukeskuksia, mikä voi myös tukea autoreaktiivisten plasmasolujen tuotantoa paikallisen tulehduksen kohdalla.
Nämä rakenteet paikallistuvat yhdessä harmaata ainetta olevien leesioiden ja parenkymaalisen (eli elimistön peruskudokseen – parenkyymiin liittyvä) tunkeutumisen kanssa, ja niitä esiintyy eri kehitysvaiheissa, aina yksinkertaisista T- ja B-soluklustereista retikuliinipäällysteen ympäröimiin erittäin järjestäytyneisiin follikkeleihin.
Follikkelimaiset kehittyneet, lymfoidiset kemokiinit CCL19, CCL21, CXCL12 ja CXCL13, jotka kontrolloivat B-solujen rekrytointia, kypsymistä ja antigeenivalintaa, ylläpitävät korkeaa humoraalista vastetta keskushermoston perifeerisestä tulehduksesta riippumatta.
Tällä on erityistä merkitystä progressiivisessa MS-taudissa, jossa veri-aivoeste toimii jokseenkin normaalisti ja taudin aktiivisuuden laukaiseva perifeeristen immuunisolujen pääsy aivoihin on vähäistä.
Sekä myeliiniantigeenien että ei-myeliiniantigeenien, kuten neurofassiinin, neurofilamenttien ja gliakaliumkanavan KIR 4, vasta-aineilla on osoitettu olevan tärkeä rooli aksonien ja hermosolujen vaurioissa komplementtikaskadiaktivaation kautta.
Progressiivisessa MS-taudissa aivokuoren demyelinaatiossa neurodegeneraatio ja atrofia osoittavat positiivista korrelaatiota diffuusien tulehduksellisten infiltraattien ja leptomeningien lymfoidi-follikkelirakenteiden kanssa, mikä osoittaa, että näiden rakenteiden aktivaatio vaikuttaa kortikaaliseen patologiaan.
Follikkelimaisia rakenteita esiintyy noin 40 prosentissa SPMS-tapauksista, mutta ne ovat harvinaisia PPMS-potilailla
Follikkelimainen, eli rakkulamainen
Ei tiedetä, ovatko follikkelimaiset rakenteet alusta alkaen tyypillisiä piirteitä taudin eri alatyypeille vai kehittyvätkö ne pysyvien kudosvaurioiden ja antigeenien vapautumisen seurauksena.
Sekundaarisesti progressiivisen MS-taudin aivokalvontulehdukseen liittyy glial limitansin vaurioituminen (ks. kuva) ja hermosolujen menetysgradientti, joka on suurempi pinnallisissa aivokuorikerroksissa (I-III) lähempänä pialin pintaa kuin sisäisissä aivokuorikerroksissa.

Diffundoivilla sytotoksisilla tekijöillä voi olla tärkeä rooli subpiaalisen aivokuoren vaurioiden kehittymisessä. Follikkelien kaltaisten rakenteiden esiintyminen SPMS-potilailla on liittynyt vakavampaan kliiniseen taudinkulkuun, lyhyempään taudin kestoon ja aikaisempaan kuolemaan.
PPMS:n ja SPMS-patologian taustalla olevat neurodegeneratiiviset ja immunologiset mekanismit ovat jäljellä. Molemmissa tapauksissa diffuusi aivokalvontulehdus ja aivokuoren hermosolujen patologia voivat olla merkittäviä tekijöitä sairauden kliinisessä etenemisessä, mikä viittaa samankaltaisiin patogeenisiin mekanismeihin riippumatta aikaisemmasta relapsoivasta remissiokurssista tai follikkelien kaltaisten rakenteiden esiintymisestä.
Epstein-Barrin virus
Taudin muotojen välillä havaitut erot ovat luonteeltaan enemmän määrällisiä kuin laadullisia.
Koska serologisissa ja epidemiologisissa tutkimuksissa on löydetty yhteys B-lymfotrooppisen Epstein-Barrin viruksen (EBV) infektion ja MS-taudin välillä, on oletettu, että keskushermostoon imeytyvien B-solujen EBV-infektio voi johtaa MS-patologiaan.
Analyysi kuolemanjälkeisestä aivokudoksesta MS-potilailla on osoittanut, että EBV-tartunnan saaneiden B-solujen / plasmasolujen kertyminen aivokalvoihin ja valkean aineen vaurioiden perivaskulaariseen osastoon on yleistä ja että EBV:ta sisältävien solujen määrä korreloi aivojen tulehduksen asteen kanssa.
EBV:n puuttuminen aivoon tunkeutuvissa B-soluissa muissa tulehduksellisissa neurologisissa sairauksissa osoittaa, että EBV:n infektoimien B-solujen pesiytyminen keskushermostoon on spesifistä MS-taudille eikä yleinen tulehduksen aiheuttama ilmiö.
Kortikaalisten vaurioiden kolonisaatio on liitetty EBV:n koodaamiin pieniin tuman mRNA (EBER) -transkripteihin B-soluissa ja plasmasoluissa, jotka ilmentyvät pääasiassa virusinfektion piilevän vaiheen aikana.
Latenssiproteiinien EBNA2 ja LMP1, jotka tuottavat lisääntymis- ja prosurvival -signaaleja B-soluille, ilmentyminen aktiivisissa valkean aineen vaurioissa ja aivokalvoissa useimmissa MS-tapauksissa, samoin kuin B-solujen lisääntymisen esiintyminen MS-aivoissa tukevat mekanismia EBV-ohjatulle B-solujen esiintymiselle.
Tutkimuksissa follikkelimaiset rakenteet sisälsivät runsaasti LMP1+:sta, mutta ei EBNA2+ -soluja. Samaan aikaan lyyttisten (liukenevien) proteiinien BZLF1 ja BERF1 havaittiin rajoittuneen plasmasoluihin, jotka sijaitsevat aktiivisissa kortikaalisissa vaurioissa, mikä osoittaa, että nämä rakenteet ovat viruksen uudelleenaktivoitumisen pääkohteita.
Koska EBNA2:ta ja LMP1:tä ilmentäviä soluja ei yleensä löydy verestä, niiden läsnäolo aivoissa viittaa EBV-säätelyn häiriöön
Joidenkin tutkimusten mukaan keskushermostoon liittyvä EBV-infektio ei kuitenkaan näyttele erityistä roolia MS-taudissa. Varhaiset lyyttiset (hajoamiseen, liukenemiseen liittyvät) EBV-antigeenit herättivät CD8+ -välitteisiä immuunivasteita aiheuttaen voimakkaita sytotoksisia vaikutuksia aivokudoksessa.
Aktiivisimmat aivokuoren MS-vauriot ovat usein täynnä CD8+ T-soluja, ja ne sisältävät vain vähän B-soluja tai plasmasoluja, mikä viittaa siihen, että kortikaalinen tulehdus korreloi sekä B- että plasmasolujen määrän vähenemisen kanssa.
Nämä havainnot viittaavat siihen, että EBV:n uudelleenaktivoituminen yhdistettynä CD8+ T-solujen välittämään voimakkaaseen sytotoksiseen viruslääkkeeseen voi johtaa akuuttiin tulehdukseen sekä valkeassa että harmaassa aineessa sekä aivokalvotilassa.
CD8+ -T-solut voivat myös tunnistaa oligodendrosyytteissä, neuroneissa tai aksoneissa läsnä olevat spesifiset antigeenit.
Aktivoituina ne voivat olla osittain vastuussa demyelinaatiosta tai aksonaalisista / hermosolujen vaurioista MS-taudissa. Useimmat MS-vaurioista toipuneet CD8+ T-lymfosyytit kuuluivat muutamiin klooneihin. Tietyt MS-potilailla löydetyt CD8+ T-solukloonit voivat säilyä monien vuosien ajan selkäydinnesteessä (CSF) ja / tai keskushermostokudoksessa.
Keskushermostosta havaittujen CD4+ T-solujen valikoima MS-potilailla on heterogeeninen. Kaiken kaikkiaan havainnot vahvistavat käsitystä siitä, että MS-potilaiden keskushermostossa olevat CD8+ T-lymfosyytit eivät ole vain sivullisia soluja, vaan ne osallistuvat aktiiviseen immuunivasteeseen.
Aksonaaliset valkean aineen vauriot korreloivat sekä CD8+ T-solujen että aktivoituneiden mikroglia / makrofagien ja keskushermostosolujen lukumäärän kanssa, joilla on voimakas MHC I -ekspressio kaikentyyppisissä tulehduksellisissa vaurioissa.
Nämä havainnot viittaavat yhdessä siihen, että valkean aineen vaurioissa CD8+ T-solut vaikuttavat efektorisoluina aiheuttaen sekä oligodendrosyyttien että aksonien vaurioita.
Taustalla olevista mekanismeista, joiden kautta sytotoksiset CD8+ T-lymfosyytit vahingoittavat aksoneja ja neuroneja MS-taudissa, on kuitenkin edelleen kiistaa.
Sytotoksiset CD8+ T-lymfosyytit vapauttavat sytokiinejä, kuten IFN-y ja TNF-a, samoin kuin perforiini ja grantsyymit A ja B.
IFN-y voi lisätä glutamaatin neurotoksisuutta ja Ca2+ -virtausta soluihin moduloimalla IFN-y / AMPA-glutamaattireseptorikompleksia. Toisaalta TNF-a laukaisee solukuoleman hermosoluissa olevan p55-reseptorin kautta.
Perforiini ja grantsyymit vahingoittavat suoraan solukalvoa aiheuttaen Na+– ja Ca2+ -virtauksen, mikä johtaa lopulta energian puutteeseen ja sen seurauksena lyyttisten soluentsyymien aktivoitumiseen.
Grantsyymit häiritsevät kalsiumin homeostaasia lisäämällä lepotasoa ja parantamalla IP3-välitteistä endoplasman verkkokalsiumin vapautumista. Kohonneet Ca2+ -pitoisuudet ovat riittäviä aktivoimaan kalsiumriippuvaisia solukuolemaan vaikuttajia, kuten kaspaasit.
Vaikka perforiini lisäsi GrB-välitteistä neurotoksisuutta, rekombinantti GrB voi itse aiheuttaa neurotoksisuutta perforiinista riippumatta.
Samoin CD8+ -sytotoksisten T-lymfosyyttien Fas-antigeenin ja hermosolujen Fas-ligandin välinen vuorovaikutus laukaisee Ca2+:n vapautumisen solunsisäisistä varastointipaikoista, mikä johtaa solunsisäisen kaspaasikaskadin lisäaktivaatioon, mikä vaurioittaa aksoneita ja neuroneita.
Sytotoksisten CD4+ T-solujen rooli progressiivisessa MS:ssä unohtuu usein
Tuoreet tutkimukset osoittivat kuitenkin, että tämä T-solupopulaatio lisääntyi myöhäisissä / kroonisissa kokeellisissa autoimmuunisissa enkefalomyeliitti- (EAE) vaurioissa verrattuna akuutteihin vaurioihin.
Sytotoksisten CD4+ T-solujen osuudet lisääntyivät edelleen SPMS-potilaiden selkäydinnesteessä (CSF) vastaaviin verinäytteisiin verrattuna.
Nämä solut syntyvät toistuvasta antigeenisesta stimulaatiosta, minkä jälkeen ne menettävät rinnakkaistimulaattorimolekyylin CD28, jolloin sytotoksinen fenotyyppi on verrattavissa NK- ja CD8+ T-soluihin. Lisäksi CD4+ CD28-T-solut menettävät herkkyytensä apoptoosin induktioon ja ovat resistenttejä niitä säätelevien T-solujen tukahduttaville vaikutuksille.
CD4+ CD28-T-solujen lisääntyminen liittyy useisiin autoimmuuni- ja kroonisiin tulehdustiloihin, kuten MS, kun taas terveillä niitä ei yleensä havaita.
Ne on tunnistettu paitsi kroonisten tulehdussairauksien potilaiden verenkierrossa myös kohdekudoksissa. MS:ssä CD4+ CD28-T-solut kykenevät kulkeutumaan keskushermostoon pääasiassa fraktalkiinijärjestelmän (CX3CL1-CX3CR1) kautta.
Potilailla, joilla on paljon näitä soluja, on vakavampi sairaus ja yleensä huonompi ennuste
Itse asiassa äskettäin CD4+ CD28-T-solujen lähtötason prosenttiosuus liittyi multimodaalisesti herätettyyn potentiaaliin (EP), mikä osoitti yhteyden näiden solujen ja taudin vakavuuden välillä.
Lähtötason CD4+ CD28-T-solujen prosenttiosuudella oli ennustearvo, koska se liittyi EP:hen 3 vuoden kuluttua ja EP:n ja laajennetun vammaisuuden tila-asteikkoon (EDSS) viiden vuoden kuluttua.

Uusien ja tehokkaiden hoitostrategioiden kehittämiseksi on tarpeen ymmärtää paremmin tautiin liittyvät patologiset mekanismit.
Tässä artikkelissa kirjoittajat ovat tiivistäneet joitakin tärkeimmistä mekanismeista, jotka liittyvät MS-taudin etenemiseen. Epäilemättä lisätutkimukset johtavat parempaan ymmärrykseen demyelinaatio- / remyelinoitumisprosesseista sekä gliasolujen merkityksestä hermosolujen homeostaasissa ja hermosolujen rappeutumisessa.
Tehokkaiden hoitomuotojen kehittäminen riippuu suurelta osin taudin patogeneesin kattavasta ymmärryksestä, eläinmalleista, jotka sisältävät nämä patogeeniset ominaisuudet, uusista koemalleista sekä uusista lääkäreiden ja perustutkijoiden yhteistyömalleista.
Pahoittelen, jos tekstiin jäi kirjoitus- tai asiavirheitä. Aineevaihduntaa ja biokemiallisia prosesseja käsittelevän tekstin ymmärrettäväksi suomentaminen on haastavaa.
Tämä on ensimmäinen osa tutkimuskatsausta: Neurodegeneraation ja aksonaalisten vaurioiden mekanismit progressiivisessa multippeliskleroosissa