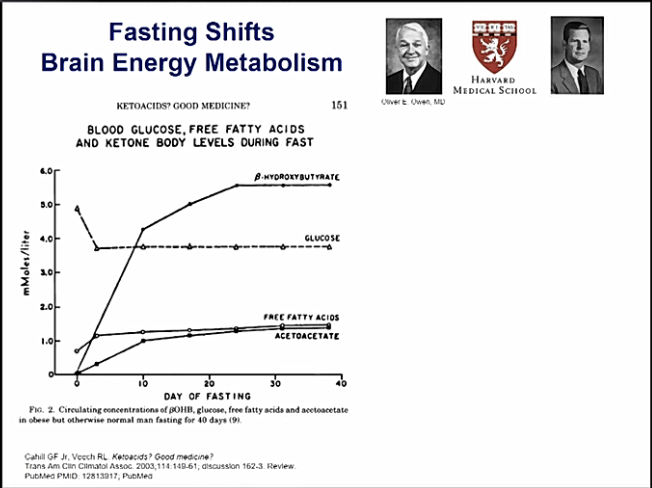
β-hydroksibutyraatin oksidaatio edistää immunometaboliittien kertymistä aktivoituneisiin mikroglia-soluihin
Adrian Beniton, Nabil Hajjin, Kevin O’Neill’n, Hector C. Keunin, & Nelofer Syedin tutkimus on julkaistu elokuun 26. päivänä 2020: 10.3390/metabo10090346
Sairastan etenevää MS-tautia. Olen aiemmissa artikkeleissa useita kertoja viitannut ketogeeniseen ruokavalioon yhtenä MS-taudin progressiota hidastavana terapiavaihtoehtona. Lisääntyvä kliininen näyttö osoittaa, että solujen glukoosinoton troofinen häiriö vaikuttaa neurodegeneraatioon Parkinsonin ja Alzheimerin tautien lisäksi myös mm. progressiivisessa multippeliskleroosissa.
Tässä katsauksessa kummastellaan mihin ketogeenisen ruokavalion vaikutus hermosoluja suojaavana, eli neuroprotektiivisena terapiana perustuu. Lets go!
Laajennan ja yritän parhaani mukaan myös selventää Beniton, Haijin et. al. tutkimusta
Saatteeksi: Neurologi ja kirjailija: Dr. Sophie Christoph kirjoittaa ketogeenisesta ruokavaliosta MS-taudin terapiana:
Ketogeeninen ruokavalio voi muuttaa immuunivastetta ja siten vaikuttaa MS-taudin etenemiseen. Eläinkokeet vahvistavat tämän havainnon.
Lihavuus on MS-taudin oireita pahentava riskitekijä. Ketogeeninen ruokavalio voi hillitä taudin etenemistä ja siihen liittyviä tulehdustiloja laihtumisen seurauksena. Viimeaikaiset tutkimukset viittaavat ruokailutottumusten ja sairauden tai oireiden vakavuuden väliseen vahvaan korrelaatioon.
Suuressa poikkileikkaustutkimuksessa ruokavalion laatuun ja aktiiviseen elämäntapaan liittyi kohentunut vireys, alhaisempi väsymys, ahdistuksen ja masennuksen lieveneminen, kognitiivisten kykyjen paraneminen ja neurologisten särkyjen helpottuminen.
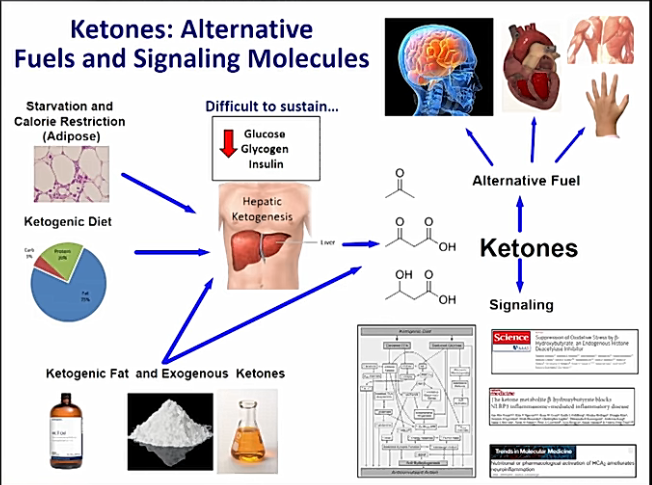
Ketogeeninen ruokavalio tarjoaa vaihtoehtoisen energialähteen hermosoluille. Koska solujen rappeutuminen on ainakin osittain seurausta solujen glukoosinoton heikkenemisestä, betahydroksibutyraatti energiasubstraattina turvaa solujen energiansaannin.
Ketogeeniset ruokavaliot imitoivat aineevaihdunnan tasolla paastotilaa. Aineenvaihdunta siirtyy pois glykolyysin tuottamasta energiantuotannosta ja kohti rasvahappojen beeta-oksidaatiota ensisijaisena energialähteenä.
Ketogeeninen ruokavalio voi olla hyödyllinen MS-potilaille, koska:
- ROS:ia ja RNS:iä (reaktiivisia happi- ja typpiradikaaleja) muodostuu vähemmän
- veri-aivoesteen läpi kulkeutuvat ketoaineet säätelevät antioksidanttien signalointireittejä
- ketoaineet lisäävät energiantuotantoa aivokudoksessa
- eläimillä ja ihmisillä tehdyt tutkimukset vahvistavat, että ketogeeniset ruokavaliot vähentävät tulehduksellisia biomarkkereita veressä ja aivo-selkäydinnesteessä
- kokeellisen autoimmuunisen enkefaliitin (EAE) hiirimallissa ketogeeninen ruokavalio johti motorisen vamman korjaantumiseen, parempaan oppimiseen ja muistiin, suurempiin hippokampuksen tilavuuksiin ja periventrikulaaristen vaurioiden remyelinaatioon
- tulehduksellisten sytokiinien tukahdutettuun tuotantoon
- lisääntyneisiin hermosolujen korjausprosesseihin
- ketogeeninen ruokavalio parantaa MS-potilaiden väsymystä, masennusta ja laskee painoa
- ketogeeninen ruokavalio ehkäisee ja parantaa MS:n aiheuttamaa neurodegeneraatiota ja neuroinflammaatiota
Mitokondrioiden toimintahäiriöt näyttävät olevan keskeisiä MS-patogeneesin neurodegeneratiivisessa vaikutuksessa. Tämä johtaa ATP:n heikompaan saatavuuteen, mikä voi edistää aksonin atrofiaa ja rappeutumista.
In vitro– ja eläintutkimusten mukaan ketogeenisen ruokavalion on osoitettu parantavan mitokondrioiden toimintaa ja edistävän siten aksonien terveyttä edistämällä ATP-tuotantoa ja mitokondrioiden biogeneesiä, ohittamalla mitokondrioiden häiriintyneet prosessit, lisäämällä antioksidanttien määrää ja vähentämällä oksidatiivisia vaurioita.
Tutkimukset ovat raportoineet merkittäviä eroja suolistobakteerien pitoisuudessa, monimuotoisuudessa ja koostumuksessa MS-potilailla ja niiden vaikutuksessa immuunijärjestelmän säätelyyn. Noin 3 kuukauden ketogeenisen ruokavalion jälkeen tämä tila parani myös MS-potilailla.
Tietoa kertyy jatkuvasti. Tälläkin hetkellä on käynnissä useita tutkimuksia, joissa selvitetään ketoosin vaikutuksia aivojen rappeutumista aiheuttaviin neurodegeneratiivisiin tauteihin, kuten Parkinsonin tauti, Alzheimerin tauti ja primaaristi progressiivinen MS.

Immuunisolujen metabolinen säätely on keskeinen vaikuttaja immunologisissa tapahtumissa
Julkaisin Ruokasodassa hiljattin kaksi tätä aihetta syventävää pitkää tutkimuskatsausta (Neurodegeneraation ja aksonaalisten vaurioiden mekanismit progressiivisessa multippeliskleroosissa: 1 & 2). Ketogeenisen ruokavalion myönteisiä vaikutuksia primaaristi progressiivisessa multippeliskleroosissa on kuvattu tässä: Ketogeeninen ruokavalio ja PPMS.
Pidemmittä puheitta, mennään asiaan
Tieto leukosyyttien metabolisesta säätelystä on lisääntynyt valtavasti, mutta keskushermoston mikroglia-solujen metabolisesta säätelystä tiedetään yhä paljon vähemmän. Tässä tutkimuksessa osoitetaan, että muiden hermoston solujen tapaan, myös mikroglia-solut pystyvät hapettamaan betahydroksibutyraatista energiaa sitruunahappokierrossa.
Vaihtoehtoisten ravintoaineiden rooli hermosolujen energiasubstraattina tunnetaan huonosti. Vielä vuosituhannen alkupuolella lähtökohtainen oletus oli, että aivojen solut eivät toimi ilman glukoosia. Tämä käsitys kuitenkin kumottiin virheellisenä viimeistään 1960-luvulla. Tieto ei saavuttanut laajemmin lääketieteellistä yhteisöä ja tutkimus jäi pienen piirin kuriositeetiksi.
Ongelmana ovat pitkään olleet tutkimusmenetelmien rajoitukset. Aineenvaihdunnan määrittelyssä on pitänyt tuvautua kovien faktojen lisäksi arvauksiin ja valistuneisiin mielipiteisiin.
Uusilla kehittyneemmillä tutkimusmenetelmillä nähdään tarkemmin ja syvemmälle. Aineenvaihdunnan mekanismeja voidaan korjata siellä, missä on veikattu väärää hevosta. Tämä selittää sen, että tieto aineenvaihdunnan mekanismeista täsmentyy nopeasti.
Glukoosin uskottiin olevan välttämätöntä aivoille, vaikka glukoosin saantia rajoittavaa ketogeenista ruokavaliota on käytetty lääkeresistentin epilepsian kohtausten hillitsemiseen noin sadan vuoden ajan. Hiilihydraattien (glukoosin) rajoittamista sovellettiin menestyksellisesti diabeteksen hoitoon jo 1700 ja 1800 lukujen vaihteessa. Ketogeenisen ruokavalion hyödyt eivät ole uusi ilmiö. Ne tunnettiin vuosituhansia ennen, kuin hiilihydraattien rajoittamisen terveyshyödyt unohdettiin viime vuosisadan puolenvälin jälkeen.
Ketogeeninen ruokavalio, aivan kuten paasto, olisi käytännössä mahdotonta, jos elimistöllä ei olisi mekanismeja korvata glukoosin saantia aivosolujen energianlähteenä muilla energiasubstraateilla.

β-hydroksibutyraatin oksidaatio edistää immunometaboliittien kertymistä aktivoituneisiin mikroglia-soluihin
Tässä tutkimuksessa käytettiin stabiilien isotooppien (13C) jäljitysstrategioita ja metabolomiikkaa* hahmottamaan β-hydroksibutyraatin (BHB) oksidatiivista metaboliaa ihmisen (HMC3) ja hiiren (BV2) mikroglia-soluissa sekä β-hydroksibutyraatin vuorovaikutusta glukoosin kanssa lepo- ja LPS- elli lipopolysakkaridi-aktivoidussa BV2:ssa.
Lipopolysakkarideja esiintyy gramnegatiivisten bakteerien ulkokalvon pinnalla, jossa ne toimivat endotoksiineina ja aktivoivat elimistön immuunijärjestelmän.
*Metabolomiikka on uusi menetelmä, jolla tutkitaan pienimolekyylisten metaboliittien rakennetta, toimintaa ja yhteisvaikutuksia elimistön soluissa, kudoksissa, veressä ja eritteissä.
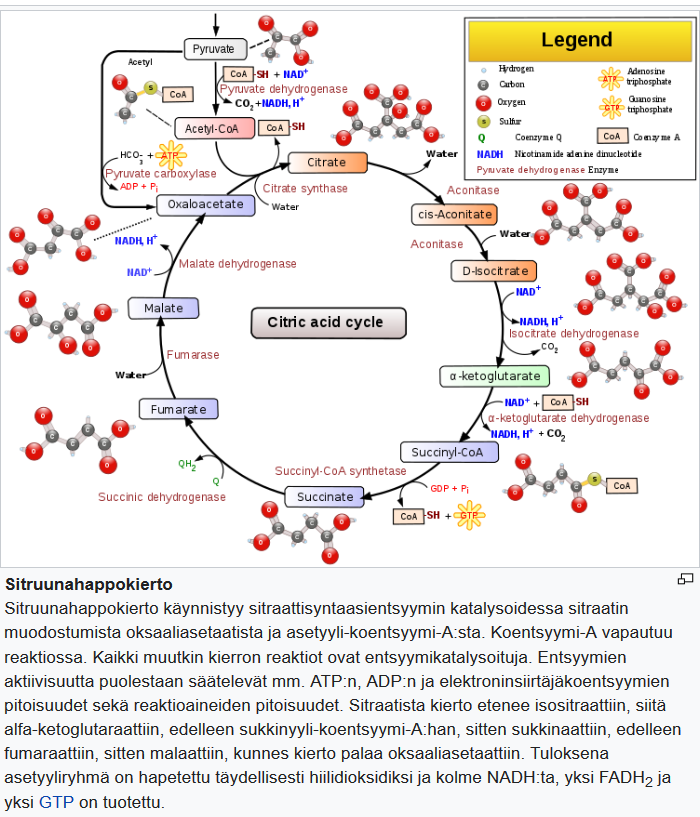
β-hydroksibutyraatti tuodaan ja hapetetaan TCA-syklissä eli sitruunahappokierrossa molemmissa solulinjoissa, minkä jälkeen sytosolinen NADH : NAD+ -suhde muuttuu.
Nikotiiniamidiadeniinidinukleotidi (NAD+)NAD+ eli nikotiiniamidiadeniinidinukleotidi on kaikissa elävissä soluissa esiintyvä tärkeä koentsyymi. Rakenteeltaan se on dinukleotidi, jossa nikotiiniamidiemäksen sisältävä nukleotidi ja adeniininukleotidi ovat liittyneet toisiinsa fosfaattiryhmiensä välityksellä. NAD+ ja sen pelkistynyt muoto NADH toimivat koentsyymeinä monissa tärkeissä biologisissa hapetus-pelkistysreaktioissa. NAD+ muistuttaa rakenteeltaan toista tärkeää koentsyymiä NADP+:a eli nikotiiniamidiadeniinidinukleotidifosfaattia, jossa lisäksi on adenosiiniin liittynyt fosfaattiryhmä.NAD+ osallistuu lähinnä katabolisiin reaktioihin, kun taas NADP+:lla on tärkeä rooli anabolisissa reaktioissa. Eliöt tuottavat NAD+:a kahdella eri tavalla. Niin sanotussa de novo -synteesissä, jota säätelevät BNA-geenit, eliöt valmistavat aminohappo tryptofaanista kinoliinihappoa. Kinoliinihappo muutetaan nikotiinihappomononukleotidiksi, joka muutetaan nikotinaattinukleotidiadenylyylitransferaasientsyymin avulla desamino-NAD+:ksi. NAD+-syntaasientsyymi muuttaa desamino-NAD+:n NAD+:ksi. Eliöt biosyntetisoivat NAD+:a myös sen hajoamisessa syntyvästä nikotiiniamidista. Nikotiiniamidi muutetaan nikotiiniamidaasientsyymin avulla nikotiinihapoksi. Nikotiinihaposta muodostetaan nikotiinihappomononukleotidia, joka muokataan NAD+:ksi kuten de novo -synteesissä. NAD+ on bioreaktioissa hapetin ja NADH pelkistin. NAD+ kiinnittyy entsyymeihin, jotka katalysoivat dehydrausreaktioita. Tällaisia ovat esimerkiksi glykolyysin yhteydessä tapahtuva glyseraldehydi-3-fosfaatin muuttaminen 1,3-bisfosfoglyseraatiksi, alkoholien hapettaminen aldehydeiksi, jota katalysoi alkoholidehydrogenaasi sekä glutamaatin hajotus. Muita entsyymejä, joille NAD+ toimii koentsyyminä, ovat muun muassa UDP-galaktoosiepimeraasi, adenosyylihomokysteinaasi, 3-dehydrokinaattisyntaasi, ornitiinisyklodeaminaasi ja urokanaasi.- Wikipedia |
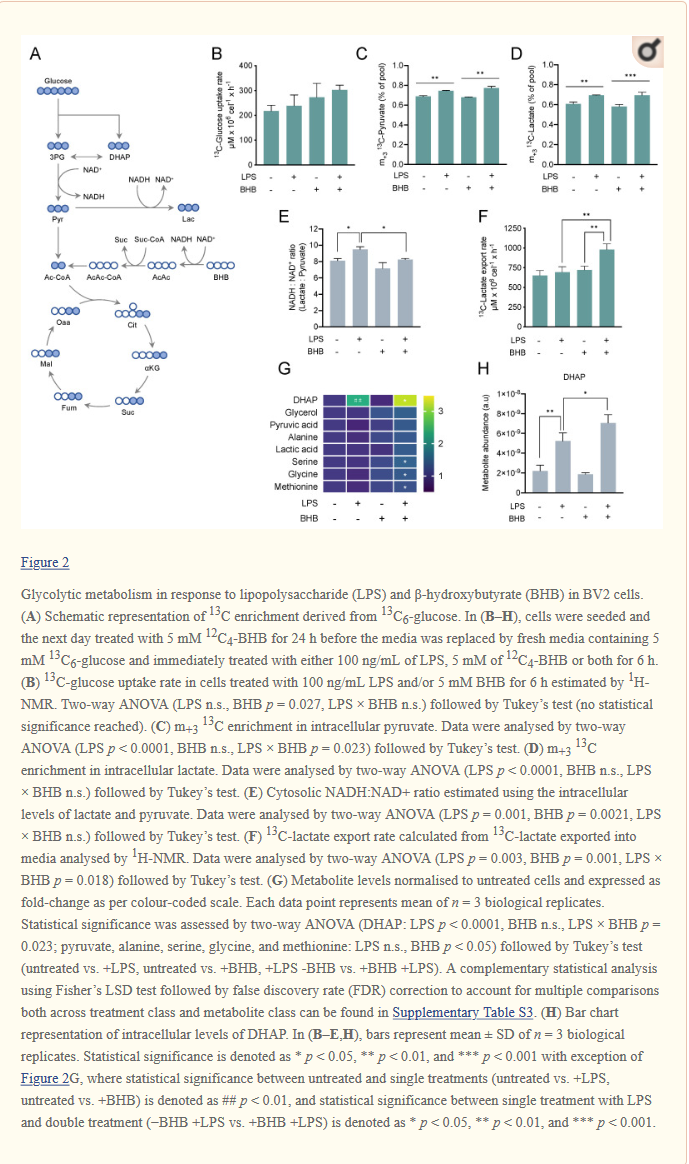
BV2-soluissa stimulaatio lipopolysakkaridilla sääteli glykolyyttistä virtausta, lisäsi sytosolista NADH : NAD+ -suhdetta ja edisti glykolyyttisen dihydroksiasetonifosfaatin (DHAP) välituotetta.
β-hydroksibutyraatin lisääminen lisäsi LPS:n aiheuttamaa DHAP:n kertymistä ja edisti glukoosista johdetun laktaatin vientiä.
β-hydroksibutyraatti (BHB) lisäsi myös synergistisesti sukkinaatin ja muiden keskeisten immunometaboliittien, kuten sitruunahappokierron tuottamien a-ketoglutaraatin ja fumaraatin, LPS:n aiheuttamaa kertymistä. Lopuksi BHB sääteli avaintulehdusta edistävän (M1-polarisaatio) markkerigeenin, NOS2:n, ilmentymistä LPS:llä aktivoiduissa BV2-soluissa.
Yhteenvetona: havaitsimme β-hydroksibutyraatin mahdollisesti immunomoduloivaksi metaboliseksi substraatiksi, joka säätelee metabolista uudelleenohjelmointia tulehdusta edistävän vasteen aikana.
Betahydroksibutyraatti, β-hydroksibutyraatti eli betahydroksivoihappo tai BHB
Rakkaalla lapsella on monta nimeä. β-hydroksibutyraatti eli β-hydroksivoihappo on energia–aineenvaihdunnassa syntyvä ketoniyhdiste eli ns. ketoaine. Muita elimistön ketoaineita ovat asetoni ja asetoasetaatti.
Ketoaineita muodostuu elimistön energiatilan mukaisesti joko vapaista eli esteröitymättömistä rasvahapoista (free fatty acids eli FFA/non-esterified fatty acids eli NEFA) tai haihtuvista rasva-hapoista (volatile fatty acids eli VFA).
Ketoaineet erittyvät vapaasti munuaisissa virtsaan, joten virtsasta voidaan havaita ketoaineita melko pian ketoottisen tilanteen alkamisen jälkeen. On kuitenkin hyvä muistaa, että virtsaliuskojen ketoainemääritys havaitsee vain asetoasetaatin (ja vähemmässä määrin asetonin), muttei β-hydroksibutyraattia. β-hydroksibutyraatti on se ketoaine, jota syntyy eniten ketoosissa.
Ihmisillä β-hydroksibutyraatti voidaan syntetisoida maksassa rasvahappojen (esim. Butyraatti), β-hydroksi-β-metyylibutyraatin ja ketogeenisten aminohappojen aineenvaihdunnan reaktioiden avulla. Aineenvaihdunta muuttaa nämä yhdisteet asetoasetaatiksi, joka on ensimmäinen ketoaine, joka tuotetaan paastotilassa.
β-hydroksibutyraatin biosynteesiä asetoasetaatista katalysoi β-hydroksibutyraattidehydrogenaasientsyymi. Butyraatti voidaan myös metaboloida β-hydroksibutyraatiksi toisen metaboliareitin kautta, joka ei sisällä asetoasetaattia metabolisena välituotteena.
Tämä metabolinen reitti on seuraava β-hydroksibutyraatin pitoisuus ihmisen veriplasmassa, kuten muissakin ketoelimissä, kasvaa ketoosin kautta. Tämä kohonnut β-hydroksibutyraattitaso on luonnollisesti odotettavissa, koska p-hydroksibutyraatti muodostuu asetoasetaatista.
Aivot voivat käyttää β-hydroksibutyraattia energialähteenä, kun verensokeri on alhainen.
Diabetesta sairastavien potilaiden ketonitasot voidaan mitata virtsan tai veren kautta diabeettisen ketoasidoosin (happomyrkytys) osoittamiseksi.
Ketogeneesi tapahtuu, kun maksasolujen oksaloasetaatti ehtyy, mikä johtuu vähentyneestä hiilihydraattien saannista (ruokavalion tai paaston seurauksena).
Koska oksaloasetaatti on ratkaisevan tärkeä tekijä asetyyli-CoA:n (asetyylikoentsyymi-A on kaikkien energiaravinteiden välimuoto sitruunahaoppokierrossa) pääsemiseksi TCA-sykliin (trikarboksyylihappokeirto) eli sitruunahappokiertoon, asetyyli-CoA:n nopea tuotanto rasvahappohapetuksesta runsaan oksaloasetaatin puuttuessa ylittää TCA-syklin heikentyneen kapasiteetin ja tuloksena oleva ylimäärä asetyyli-CoA siirtyy kohti ketoaineiden tuotantoa.
β-hydroksibutyraatti pystyy läpäisemään keskushermostoa suojaavan veri-aivoesteen
Näin se pääsee ravitsemaan keskushermoston soluja. β-hydroksibutyyrihappotaso kasvaa maksassa, sydämessä, luurankolihaksissa, aivoissa ja muissa kudoksissa liikunnan, kalorien rajoittamisen, paaston ja ketogeenisten ruokavalioiden seurauksena.
Yhdisteen on havaittu toimivan histonideasetylaasin (HDAC) estäjänä. Estämällä HDAC-luokan I isoentsyymien HDAC2 ja HDAC3, β-hydroksibutyraatin on havaittu lisäävän aivoperäisen neurotroofisen tekijän (BDNF) pitoisuutta ja TrkB-signalointia hippokampuksessa.
Jyrsijätutkimuksissa on havaittu, että pitkäaikainen liikunta lisää plasman β-hydroksibutyraattipitoisuuksia, mikä indusoi BDNF-geenin promoottoreita hippokampuksessa.
Näillä havainnoilla voi olla kliininen merkitys masennuksen, ahdistuneisuuden ja kognitiivisten vajaatoimintojen hoidossa. Ketogeenistä ruokavaliota käyttävillä epilepsiapotilailla veren β-hydroksibutyraattitasot korreloivat parhaiten kohtausten hallinnan asteen kanssa. Optimaalisen antikonvulsanttivaikutuksen kynnys näyttää olevan noin 4 mmol / l.
Tutkimus
Mikroglia-solut ovat keskushermoston (CNS) immuunisoluja. Arviolta 10% kaikista keskushermoston soluista on mikroglia-soluja.
Nämä solut ovat viime aikoina herättäneet runsaasti kiinnostusta, koska niillä on kriittinen rooli yleisimmissä aivosairauksissa, kuten dementia, aivohalvaus ja aivokasvaimet. Aivosairaudessa tai immuunialtistuksessa levossa oleva mikroglia hyväksyy ohjelmalliset muutokset, jotka liittyvät sytokiinien ja kemokiinien vapautumiseen.
| Sytokiinit ja kemokiinit Sytokiini on proteiinirakenteinen solujen välisen viestinnän välittäjäaine, joka on löydetty immunologisen tutkimustyön yhteydessä. Sytokiinin ja kasvutekijän, joka on toinen paikallisesti vaikuttava kudoshormonityyppi, välinen ero on lähinnä löytöhistoriasta, eikä toimintatavasta tai muista ominaisuuksista johtuva. Valkosolut tuottavat suurimman osan sytokiineista. Immuunijärjestelmän ohjaus on niiden keskeisin tehtävä. Immuunijärjestelmää ohjailevat sytokiinit voidaan jakaa toimintansa pääasiallisen luonteen perusteella viiteen pääryhmään: tuumorinekroositekijät, interferonit, interleukiinit, hematopoieettiset kasvutekijät ja muut kasvutekijät. Sytokiineja voidaan luokitella myös tuottajasolujensa mukaan. Esimerkiksi lymfosyyttien tuottamia sytokiineja kutsutaan lymfokiineiksi ja monosyyttien monokiineiksi. Tuumorinekroositekijät (TNF) ovat ehkä keskeisimpiä ensisijaisia aktivoivia välittäjäaineita immunovasteen käynnistyksessä. Tuumorinekroositekijän nimi juontuu sen löytöhistoriasta, kun joidenkin syöpäpotilaiden kasvainten havaittiin surkastuvan bakteeritulehduksen yhteydessä. Myöhemmin saatiin selville, että kasvainten tuhoutumiseen vaikuttaa keskeisesti eräiden valkosolujen, makrofagien ja T-lymfosyyttien, tuottama proteiini, joka ristittiin tuumorinekroositekijäksi. Hematopoieettiset kasvutekijät ohjailevat ja stimuloivat immunojärjestelmän solujen erilaistumista ja tuotantoa luuytimessä ja muissa verisoluja muodostavissa kudoksissa. Immunojärjestelmän kannalta ehkä keskeisin hematopoieettinen kasvutekijä on granulosyytti-makrofagi-solulinjaa stimuloiva tekijä. – Wikipedia Kemokiinit saavat aikaan kemotaksista eli solun liikkumista joko suurempaa kemokiinipitoisuutta kohti tai siitä poispäin. Kemokiinit ovat yli 40 tunnetun molekyylin joukko rakenteeltaan samankaltaisia, pienikokoisia polypeptidejä (8-14 kDa), jotka sitoutuessaan kemokiinireseptoreihin aktivoivat ne. Kemokiinit ja niiden reseptorit luokitellaan C, CC, CXC ja CXXXC perheisiin sen mukaan, miten kemokiinin N-terminaalinen kysteiini paikantuu. Kemokiinireseptorit ovat luonteeltaan G-proteiineja, joiden aktivoituminen käynnistää sarjan biokemiallisia reaktioita, kuten fosfatidyyli-inositolitrifostaatin hydrolysoitumisen, proteiinikinaasi C:n aktivoitumisen, kalsium-ionien sisänvirtauksen, sekä rac- ja Rho-proteiinien aktivaation. Rac ja Rho osallistuvat solun migraatioon säädellen aktiiniverkoston rakentumista lamellipodeissa ja filopodeissa. Kemokiinien on osoitettu säätelevän erilaisia immuunijärjestelmän vasteita siten, että T-solujen alalajit ilmentävät eri kemokiinireseptoreita. Tämä puolestaan vaikuttaa siihen, mihin kudoksiin kyseiset T-solut voivat vaeltaa. Monosyyteissä ja lepäävissä T-soluissa esiintyvät kemokiinireseptorit CCR5 and CXCR4 osallistuvat tulehdusreaktioihin, ja samat reseptorit avustavat HIV-virusten tarttumisessa T-soluihin. – Solunetti |

Nämä polarisoidut solut on perinteisesti luokiteltu joko tulehdusta edistäviksi (M1-tyyppi) tai anti-inflammatorisiksi (M2-tyyppi) muutaman molekyylimarkkerin ilmentymisen mukaan. Molekyylit, kuten lipopolysakkaridi (LPS) ja interferoni-y (IFN-y), ovat voimakkaita M1-polarisaation promoottoreita, kun taas IL-4 indusoi M2-polarisaatiota.
Todisteiden lisääntyminen on kuitenkin osoittanut M1 / M2-kehyksen rajoitukset. Mikroglian polarisaatio on edelleen intensiivisen tieteellisen tutkimuksen aiheena. Lisääntyvä tutkimusnäyttö antaa ratkaisevan merkityksen solujen aineenvaihdunnalle mikrogliumin toiminnan ja polarisaation säätelyssä.
Solunulkoinen metabolinen ympäristö ja metabolisten reaktioiden ohjaamat muutokset solunsisäisessä aineenvaihduntaympäristössä, moduloivat vasteen immunologisiin signaaleihin.
Perifeerisissä immuunisoluissa mekanismit, joilla tulehdus vaikuttaa energia-aineenvaihduntaan, tunnetaan jo hyvin. Mikroglia-alueen viimeaikaiset havainnot osoittavat, että tämä immuunisolutyyppi sitoutuu erilaisiin metaboliareitteihin stimulaatiomallista riippuen.
Paljon vähemmän tiedetään kuitenkin siitä, kuinka energia-aineenvaihdunta ja metabolinen mikroympäristö vaikuttavat immuunivasteisiin. Immunometabolian havainnot ovat osoittaneet, että perifeeriset immuunisolut voivat sopeutua vaihteleviin ympäristöhaasteisiin metaboloimalla muita vaihtoehtoisia ravintoaineita kuin glukoosia (asetaattia, aminohappoja ja rasvahappoja).
Mikrogliassa tämä ns. metabolisen joustavuuden ilmiö ja vaihtoehtoisten substraattien energia-aineenvaihdunta ymmärretään edelleen puutteellisesti. Vasta äskettäin raportoitiin, että mikroglia voi glukoosin puuttuessa siirtyä käyttämään glutamiinia vaihtoehtoisena polttoaineena mikrogliafunktion ylläpitämiseksi.
Metabolisen joustavuuden merkitys lisääntyy samalla, kun metabolisen mikroympäristön merkityksestä immuunitoiminnan säätelylle saadaan lisää todisteita
Äskettäin on keksitty termi immunometaboliitit tai sytokiinien kaltaiset metaboliitit kuvaamaan metaboliitteja sukkinaattia, itakononaattia, laktaattia, fumaraattia ja a-ketoglutaraattia. Nämä ovat metaboliitteja, joilla on tärkeä vaikutus leukosyyttien aktivaatiossa ja erilaistumisessa, ja jotka ovat riippumattomia niiden tavanomaisesta roolista biosynteesissä ja bioenergeettisissä aineissa.
Ruokavalio-interventiot ovat osoittaneet terapeuttista potentiaalia aineenvaihduntaympäristön ja immuunijärjestelmän säätelijöinä. Tällaisista ruokavalioista ketogeeniset ruokavaliot ovat olleet suosittuja erityisesti aivosairauksien, kuten epilepsian ja gliooman (aivokasvain) hoidossa.
| Huomio: Multippeliskleroosi aiheuttaa todellista tuhoa keskushermoston valkeassa ja harmaassa aineessa.Arpeumat ja kuolleiden neuroneiden muodostamat ”mustat aukot” ovat yhtä todellisia kuin amputoitu sormi tai varvas, joka ei ihmeenomaisesti jotain eliksiiriä nauttimalla kasva takaisin.
Ruokavalio-interventio terapiana hidastaa ja ehkäisee uusien hermostovaurioiden syntyä. Olemassaolevat vauriot voivat ehkä jossain määrin korjautua vuosien tai vuosikymmenten aikana neurogeneesin, remyelinaation ja neuroplastisuuden avulla, mutta sellaisesta ei ole tieteellistä näyttöä. Yhtä kaikki, ketogeeninen ruokavalio hidastaa ja ehkäisee uusien leesioiden syntyä. Sen parempaan nykylääketiede ei oikein MS-taudin kohdalla pysty. Tämä on masentavaa, mutta samalla rohkaisevaa. Se on se, mitä me multippelisklerootikot voimme itsellemme antaa. Kukaan ei osaa korjata jo syntyneitä valkean ja harmaan aineen vaurioita, mutta me voimme ehkäistä uusien vaurioiden syntymistä ja hidastaa invalidisoivaa prosessia. |
Tähän ruokavalioon liittyvien monien terveysvaikutusten joukossa ketoaine β-hydroksibutyraatin (BHB) endogeenisen tuotannon lisääntyminen on yksi biologisesti merkittävimmistä vaikutuksista.
Todiste tämän metaboliitin merkityksellisyydestä on se, että β-hydroksibutyraatti yksinään annettuna tuottaa ketogeenisen ruokavalion hyödylliset vaikutukset äärimmäisissä olosuhteissa.
Tämä on ajankohtainen aihe. NASA rahoittaa β-hydroksibutyraatin ja ketoosin vaikutuksia selvittäviä tutkimuksia, koska tulevaisuuden Mars-lentojen astronauttien aineenvaihdunta ja kognitiiviset kyvyt äärioloissa halutaan maksimoida. USAn puolustusministeriö rahoittaa ketoaineiden ja ketoosin tutkimusta, koska ketoosin uskotaan parantavan taistelusukeltajien toimintakykyä äärioloissa.
Ketoosin neuroprotektiiviset ja kognitiota tehostavat vaikutukset todentuvat erityisen hyvin äärioloissa. Karppaus ei vittuilusta huolimatta ole enää pienen pöpiseurakunnan ruokauskonto, vaan faktisesti ihmisen aineenvaihduntaa ja immuunijärjestelmää tehostava ruokavalio.
β-hydroksibutyraatti on nelihiilinen molekyyli, joka syntyy maksan rasvahappojen hapettuessa, kun elimistö ei saa glukoosia. Se voi toimia signalointimolekyylinä sitoutumalla suoraan G-proteiiniin kytkettyyn reseptoriin GPR109A tai histonideasetylaasin (HDAC) estäjänä sekä epäsuorasti oksidatiivisen aineenvaihdunnan kautta, minkä jälkeen muodostuu asetyyli-CoA ja NADH, eli asetyylikoentsyymi-A ja nikotiiniamidiadeniinidinukleotidin pelkistynyt muoto.
Vaikka β-hydroksibutyraatin suoria signalointivaikutuksia aivoissa ja mikroglia-alueella on tutkittu laajasti eri järjestelmissä, sen metaboliaa mikrogliassa ei ole aiemmin kartoitettu.
Kun otetaan huomioon metabolisen signaloinnin ja uudelleenohjelmoinnin keskeinen rooli immuniteetissa, β-hydroksibutyraatin metabolisten vaikutusten ymmärtäminen mikrogliassa nousee perustavanlaatuiseksi kysymykseksi.
Tässä käytimme stabiilin isotoopin (13C) jäljitystä ja metabolomiikkaa β-hydroksibutyraatin oksidatiivisen aineenvaihdunnan ja glukoosimetabolian välisen vuorovaikutuksen lepo- ja LPS- eli lipopolysakkaridi-aktivoidun mikroglian vertailuun.
Arvioimme myös β-hydroksibutyraatin vaikutusta lipopolysakkaridiin kohdistuvaan tulehdusvasteeseen analysoimalla polarisaatiotuottajien ilmentymässä tapahtuvia muutoksia.
| Lipopolysakkaridi (LPS)on suurikokoinen molekyyli, joka koostuu lipidistä ja polysakkaridista. Molekyylin rakenteessa on kolme kovalenttisin sidoksin yhdistynyttä osaa: O-polysakkaridi eli O-antigeeni, ydinoligosakkaridi ja lipidi A. Lipopolysakkarideja esiintyy gramnegatiivisten bakteerien ulkokalvon pinnalla, jossa ne toimivat endotoksiineina ja aktivoivat elimistön immuunijärjestelmän. |
Tulokset
|

β-hydroksibutyraatin metabolian tutkimuksessa mikroglia-solulinjat BV2 (hiiri) ja HMC3 (ihminen) valittiin mikroglia-solumalleiksi.
β-hydroksibutyraatin pitoisuus nousee olosuhteissa, joille on tunnusomaista rajoitettu glukoosin saatavuus. Vaikka β-hydroksibutyraatin hapettumisen on jo kauan tiedetty tapahtuvan hermosoluissa, astrosyyteissä ja oligodendrosyyteissä, todisteita β-hydroksibutyraatin hapettumisesta mikroglia-soluissa ei vielä ole.
Pyrimme ensin vahvistamaan, voiko mikroglia hapettaa β-hydroksibutyraattia, sekä ymmärtämään, miten glukoosin saatavuus muuttaa β-hydroksibutyraatin aineenvaihduntaa.
Näiden hypoteesien testaamiseksi teimme stabiilin isotooppien jäljityskokeen käyttäen 13C-leimattua β-hydroksibutyraattia. 13C-leimattujen substraattien käyttö mahdollistaa hiilen kulkeutumisen jäljittämisen eri aineenvaihduntareittien kautta ja liittymisen alavirran metaboliitteihin.
β-hydroksibutyraatti hapetetaan kolmivaiheisen ketoaineiden hapetusreitin kautta, minkä jälkeen tuotetaan NADH:ta ja asetyyli-CoA:ta, jotka voidaan siirtää sitruunahappokiertoon. (Kuva 1)
BV2- ja HMC3-viljelmiä täydennettiin tasaisesti 5 mmol/l 13C-leimatulla BHB:lla (13C4-BHB) viljelyolosuhteissa, jotka eivät sisältäneet lisättyä glukoosia, 1 tai 5 mmol/l leimaamatonta glukoosia (12C6-glukoosi).
Rinnakkaisanalyysi 13C-leimatulla glukoosilla (13C6-glukoosi) vahvisti glykolyyttisen virtauksen merkittävän vähenemisen glukoosia rajoittavassa ympäristössä (kuvio S1A, B). Tuloksemme osoittivat, että sekä BV2 että HMC3 voivat tuoda ja hapettaa β-hydroksibutyraattia, kuten TCA-syklin m +2 13C-rikastus osoittaa. Välituotteina sitraatti, a-ketoglutaraatti, glutamaatti, sukkinaatti, fumaraatti ja malaatti (kuva 1B).
Tuloksemme osoittivat myös, että glukoosin saatavuus muuttaa β-hydroksibutyraatin vaikutusta eri tavalla kussakin solulinjassa. BV2-soluissa β-hydroksibutyraatin hapettuminen lisääntyi vähitellen glukoosipitoisuuden laskiessa, mikä ilmeni m+2 13C-rikastumisen kasvuna kaikissa sitruunahappokierron välituotteissa (kuvio 1B, vasemmalla).
HMC3-soluilla ei ollut samaa vastemallia, ja β-hydroksibutyraatin hapettuminen pysyi vakiona riippumatta glukoosipitoisuudesta, mistä osoittaa tasainen m +2 13C-rikastumisen osuus TCA-syklin välituotteissa (kuvio 1B, oikea).
Mielenkiintoista on, että sekä BV2- että HMC3-soluissa havaittavissa oleva osa 13C4-BHB-johdetuista hiilistä transformoitiin laktaatiksi (kuvio S2A, B) ja pyruvaatiksi (kuvio S2C, D).
Havaitsimme erityisesti solunsisäisen m+2 13C2-laktaatin lisääntymisen glukoosista riippuvaisella tavalla, mikä viittaa vaihtoehtoiseen β-hydroksibutyraatin metaboliareittiin, joka paranee glukoosia rajoittavissa olosuhteissa.
On raportoitu, että mikroglia-soluilla on joustava aineenvaihdunta ja glukoosipuutteessa ne voivat nopeasti siirtyä käyttämään glutamiinia mitokondrioiden aineenvaihdunnan ja valvontatoimintojen ylläpitämiseen. Siksi testataksemme mahdollisuutta, että β-hydroksibutyraatti voisi aiheuttaa mikroglia-proliferaation (lisääntymisen) hyvin matalan glukoosin olosuhteissa, viljelimme BV2- ja HMC3-soluja 0,1 mmol/l glukoosissa, johon oli lisätty 5 tai 10 mmol/l leimaamatonta β-hydroksibutyraattia.
Tuloksemme osoittavat, että β-hydroksibutyraatti ei aiheuttanut mikroglian lisääntymistä missään solulinjassa (kuva S2E, F). Koska sekä glukoosi että β-hydroksibutyraatinn metaboliareitit ovat mukana NADH:n tuotannossa, olimme kiinnostuneita siitä, voisiko β-hydroksibutyraatti muuttaa bioenergeettistä aineenvaihduntaa ja redox-tilaa indusoimalla muutoksia NADH : NAD+ -suhteessa.
Tämän suhteen on äskettäin raportoitu hallitsevan synnynnäisiä tulehdusvasteita transkriptionaalisen repressorin CtBP:n kautta. Sytosolinen NADH : NAD+ -suhde voidaan arvioida epäsuorasti mittaamalla laktaatin ja pyruvaatin solunsisäisten tasojen suhde (kuvio 1C) . Kuten odotettiin, 5 mmol/l glukoosissa viljellyillä soluilla oli suurempi NADH : NAD+ -suhde kuin 1 mmol/ glukoosissa viljellyillä soluilla (kuvio 1D, E).
BV2-soluissa β-hydroksibutyraatin lisääminen lisäsi NADH : NAD+ -suhdetta, kun soluja viljeltiin 5 mmol/l glukoosissa, mutta ei 1 mmol/l glukoosissa (kuvio 1D). HMC3-soluissa β-hydroksibutyraatin lisäys nosti suhdetta sekä 1 että 5 mmol/l glukoosiolosuhteissa (kuvio 1E).
Tutkimme myös β-hydroksibutyraatin isäyksen vaikutusta metaboliittitasoihin useilla metaboliareiteillä soluissa, joita viljeltiin 1 ja 5 mmol/l glukoosissa. BV2-solujen aineenvaihdunta reagoi paremmin β-hydroksibutyraattiin kuin HMC3. 1 mmol/l glukoosissa BV2-solut, joihin oli lisätty β-hydroksibutyraattia, osoittivat laktaatin, glysiinin ja glutamaatin kertymistä, kun taas 5 mmol/l glukoosissa havaittiin laktaatin kertymistä ja glutamaatin konsentraation pienenemistä (kuvio S3A).
HMC3-soluissa β-hydroksibutyraatti edisti glutamaatin kerääntymistä matalassa glukoosissa viljellyissä soluissa (kuvio S3B). Nämä tiedot yhdessä vahvistavat, että β-hydroksibutyraatti hapetetaan sitruunahappokierrossa (TCA-syklissä) mikroglia-soluissa ja edistää NADH:n tuotantoa ja sytosolisen NADH : NAD+ -suhteen säätelyä.
β-hydroksibutyraatin (BHB) hapettuminen hiiren (BV2) ja ihmisen (HMC3) soluissa.
|
β-Hydroxybutyraatti muuttaa LPS:n aiheuttaman glykolyyttisen vasteen
β-hydroksibutyraatin roolia mikrogliassa ja neuroinflammatiossa on aiemmin tutkittu erilaisissa sairausmalleissa. β-hydroksibutyraatin metabolisia vaikutuksia mikroglia-aktivaatioon ja taustalla olevaan metaboliseen uudelleenohjelmointiin ei kuitenkaan tunneta.
Tutkimusten mukaan yhä useampi todiste osoittaa, että metabolinen häiriö voi muuttaa mikroglia-vastetta immuunisignaaleihin. Siksi haluamme ymmärtää β-hydroksibutyraatin vaikutusta LPS-aktivoituun mikrogliaan liittyvään metaboliseen uudelleenohjelmointiin.
Koska BV2-solut reagoivat metabolisesti paremmin β-hydroksibutyraatin lisäykseen ja aiemmat tutkimukset olivat optimoineet LPS-stimulaation ja luonnehtineet osittain tämän solulinjan metabolista vastetta, BV2 valittiin malliksi tutkittaessa β-hydroksibutyraatin vaikutuksia LPS:n aiheuttamaan metaboliseen uudelleenohjelmointiin.
| BV2-soluja viljeltiin 5 mmol/l 13C6-glukoosin läsnä ollessa ja käsiteltiin joko 5 mmol/l 12C4–β-hydroksibutyraatilla, 100 ng / ml LPS:llä tai molemmilla 6 tuntia.Onnistuneen aktivaation vahvisti tulehdusmerkinnän NOS2 uudelleen säätely (kuvio S4A). Glykolyyttisen aineenvaihdunnan muutosten tutkimiseksi mitasimme 13C-rikastumisen ja keskeisten glykolyyttisten välituotteiden suhteellisen runsauden (kuvio 2A). Vaikka LPS-hoito ei muuttanut glukoosin ottonopeutta, havaitsimme korkeamman glukoosinottotrendin soluissa, joita hoidettiin yksin β-hydroksibutyraatilla tai yhdessä LPS:n kanssa, mikä ei saavuttanut tilastollista merkitsevyyttä (kuvio 2B).
LPS:n, mutta ei β-hydroksibutyraatin lisääminen lisäsi glykolyyttistä virtausta solunsisäisen m+3 13C-pyruvaatin (kuvio 2C) ja m+3 13C-laktaatin (kuvio 2D) nousun perusteella. |
Johdonmukaisesti tämä glykolyyttisen vuon kasvu, kun soluja käsiteltiin LPS:llä, liittyi sytosolisen NADH : NAD+ -suhteen nousuun (kuvio 2E). Pelkkä β-hydroksibutyraatin täydentäminen ei muuttanut NADH : NAD+ -suhdetta, mutta LPS:n ja β-hydroksibutyraatin yhdistelmä vähensi tätä verrattuna yksin LPS:ään. Mielenkiintoista on, että LPS:n ja β-hydroksibutyraatin vaikutukset 13C-laktaatin vientiin seurasivat eri suuntausta kuin solunsisäisen 13C-pyruvaatin ja 13C-laktaatin tuotanto. Vaikka erilliset hoidot LPS:llä tai β-hydroksibutyraatilla yksinään eivät muuttaneet 13C-laktaatin vientinopeutta, yhdistelmähoito lisäsi dramaattisesti 13C-laktaatin vientiä väliaineeseen (kuvio 2F), mikä viittaa siihen, että β-hydroksibutyraatti voisi muuttaa glukoosista otetun hiilen kohtaloa sekä laktaattimetaboliaa ja vientiä.
Tutkimme myös muutoksia joidenkin glykolyyttisten välituotteiden suhteellisessa runsaudessa (otoksen koko). Havaitsimme suuren dihydroksiasetonifosfaatin (DHAP) (kuvio 2G, H) pitoisuuden nousun LPS:llä käsitellyissä soluissa, jotka lisääntyivät enemmän, kun soluja käsiteltiin samanaikaisesti LPS:llä ja β-hydroksibutyraatilla, mikä viittaa synergistiseen metaboliseen vasteeseen molemmille aineille.
Löysimme myös seriinin, glysiinin ja metioniinin merkittäviä kertymiä, kun soluja käsiteltiin LPS:llä ja β-hydroksibutyraatilla samanaikaisesti (kuvio 2G). Nämä tulokset osoittavat yhdessä, että LPS lisää glykolyyttistä virtausta ja sytosolista NADH : NAD+ -suhdetta ja että BHB muuttaa LPS:n aiheuttamaa glykolyyttistä fenotyyppiä edistämällä laktaatin vientiä ja glykolyyttisten välituotteiden kertymistä.
β-hydroksibutyraatti edistää mitokondrioiden aineenvaihduntaa ja TCA-syklin välituotteiden kertymistä
Kuten aikaisemmin on esitetty kuviossa 1B, mikroglia-solut hapettavat β-hydroksibutyraattia sitruunahappokierrossa (TCA-syklissä). Viime vuosina useiden TCA-syklin välituotteiden on raportoitu osallistuvan immuniteetin signalointiin ja säätelyyn, mutta on epäselvää vaikuttaako tämä aineenvaihdunnan säätely myös mikrogliassa.
Lipopolysakkaridi-stimulaatiolla mitattiin sitruunahappokierron välituotteiden 13C-rikastuminen ja suhteellinen runsaus BV2-soluissa samoissa koeolosuhteissa kuin kuvassa 2. Pelkästään LPS-käsittely kasvatti 13C-glukoosista johdettujen hiilien virtausta mitokondrioihin. M+2 13C-sitraatin lisääntymieen liittyen (kuvio 3A).

Vastaavasti kuviossa 1B esitettyjen tulosten kanssa yksin β-hydroksibutyraatin lisääminen vähensi 13C-rikastumista kaikissa sitruunahappokierron välituotteissa verrattuna soluihin, joita viljeltiin ilman β-hydroksibutyraattia 13C-leimauksen laimentamisen vuoksi.
Lipopolysakkaridin lisääminen yhdessä β-hydroksibutyraatin kanssa lisäsi merkittävästi m+2 13C-sitraatin ja muiden TCA-syklin välituotteiden, kuten:
| 13C-a-ketoglutaraatin 13C-glutamaatin
13C-sukkinaatin 13C-malaatin 13C-fumaraatin osuutta verrattuna B β-hydroksibutyraattiin yksin (kuva 3A). |
Tutkimme myös muutoksia sitruunahappokierron välituotteiden ja aminohappojen suhteellisessa esiintymisessä. Erillinen käsittely lipopolysakkaridilla, muttei betahydroksibutyraatilla, lisäsi käsiteltyjen solujen sukkinaatin tasoa merkittävästi käsittelemättömiin soluihin verrattuna (kuvio 3B, C). Vastaava ilmiö on aiemmin raportoitu makrofageissa.
Sukkinaattitasot nousivat edelleen soluissa, joita oli käsitelty LPS:llä ja BHB:llä. Tämä viittaa synergistiseen vaikutukseen yhtäläisellä altistuksella näille kahdelle metaboliitille.
Pelkkä BHB-hoito ei muuttanut merkittävästi minkään tutkitun metaboliitin tasoja, mutta hoito LPS:lla ja BHB:lla yhdessä lisäsi myös immunometaboliittien fumaraatin (kuva 3D) ja a-ketoglutaraatin (kuva 3E) tasoja. Lisäksi havaittiin sitraatin, glutamaatin, malaatin ja pyroglutamaatin lisääntymistä, kun soluja käsiteltiin LPS:llä ja BHB:llä samanaikaisesti (kuvio 3B).
Tuloksemme osoittavat, että β-hydroksibutyraatti edistää mitokondrioiden metaboliaa ja sitruunahappokierron immunometaboliittien kertymistä LPS-aktivoiduihin soluihin.
β-hydroksibutyraatti tehostaa lipopolysakkaridin aiheuttaman tulehdusta ehkäisevän markkerin NOS2 stimulaatiota
β-hydroksibutyraatinn vaikutuksen ymmärtämiseksi mikroglian aktivaatiossa ja polarisaatiossa BV2-soluja käsiteltiin pienellä (1 ng / ml) tai suurella (100 ng / ml) LPS-annoksella, 5 mmol/l β-hydroksibutyraatilla tai molempien yhdistelmällä. ja määritettiin M1 (NOS2 ja IL-1p) ja M2 (ARG1) polarisaatiomerkkien ilmentyminen (kuvio 4A, B).
Stimulaatio joko pienellä tai korkealla LPS-konsentraatiolla yksin johti NOS2- ja IL-1β-ilmentymisen voimakkaaseen säätelyyn. Ainoastaan suurella LPS-pitoisuudella käsitellyt solut vähensivät merkittävästi ARG1:n ilmentymistä.
Pelkästään β-hydroksibutyraatin lisääminen ei vaikuttanut minkään geenin ilmentymiseen, mutta mikä tärkeintä, solut, joita oli hoidettu pienen LPS- ja BHB-annoksen yhdistelmällä, osoittivat NOS2-ilmentymisen lisääntynyttä säätelyä verrattuna pelkästään LPS: llä käsitellyihin soluihin.
Millaisia ajatuksia tämä herätti?
Tässä käyttämällä stabiilin isotoopin jäljitystä 13C-BHB:n kanssa olemme osoittaneet, että mikroglia-solut voivat tuoda ja hapettaa betahydroksibutyraattia sitruunahappokierrossa, jolloin sytosolinen NADH : NAD+ -suhde kasvaa myöhemmin.
Käyttämällä 13C-glukoosia havaitsimme, että lipopolysakkaridi (LPS) säätelee glykolyyttistä virtausta, lisää NADH : NAD+ -suhdetta ja edistää DHAP: n kertymistä. β-hydroksibutyraatin lisääminen lisäsi LPS:n indusoimaa DHAP:n kertymistä ja edisti glukoosista johdetun laktaatin vientiä. β-hydroksibutyraatti lisäsi myös synergistisesti sukkinaatin ja muiden keskeisten immunometaboliittien, kuten TCA-syklin tuottamien a-ketoglutaraatin ja fumaraatin, lipopolysakkaridin aiheuttamaa kertymistä.
β-hydroksibutyraatti on tärkein ketoaine yhdessä asetoasetaatin ja asetonin kanssa. Ketoaineita syntetisoituu maksassa rasvakudoksista tai ravinnon rasvahapoista. β-hydroksibutyraatin peruskonsentraatio plasmassa terveillä koehenkilöillä on suhteellisen pieni, viitearvojen ilmoitettuina 0,04–0,08 mmol/l ja tyypillisesti <0,5 mmol/l, ja se nousee erityisolosuhteissa, kuten paaston aikana (5–6 mmol/l), ketogeenisellä ruokavaliolla (1 mmol/l) tai diabeettisessa ketoasidoosissa (> 10 mmol/l).
Glukoosi on aivoille edullinen energiasubstraatti. Toisin kuin useimmat muut kudokset, aivot eivät voi käyttää rasvahappoja energiaksi, kun verensokeritaso vaarantuu. Alhaisen saatavuuden aikoina sitä voidaan kuitenkin täydentää vaihtoehtoisten substraattien, kuten monokarboksylaattipyruvaatin, laktaatin, asetaatin ja ketoaineiden hapetuksella. Suurin osa tämänhetkisestä tiedosta vaihtoehtoisten ravintoaineiden käytöstä aivosoluissa on saatu hermosoluista ja astrosyyteistä tai kokoaivokokeissa joko in vivo tai aivokuoren viipaleina.
Tuloksemme osoittavat selvästi, että mikroglia-solut BV2 ja HMC3 voivat tuoda ja hapettaa ketoaine β-hydroksibutyraattia. Monokarboksylaattikuljettimet (MCT) kuljettavat β-hydroksibutyraattia aktiivisesti aivoihin.
β-hydroksibutyraatin hapettuminen asetyyli-CoA: ksi tapahtuu lineaarisen metabolisen reaktion sekvenssin kautta, jota katalysoivat entsyymit β-hydroksibutyraattidehydrogenaasi (BDH1 / 2), sukkinyyli-CoA: 3: oksohappo-CoA-transferaasi (SCOT) ja asetyyli-CoA-asetyylitransferaasi ( ACAT1 / 2), minkä jälkeen tuotetaan yksi NADH- ja sukkinaattimolekyyli ja kaksi asetyyli-CoA-molekyyliä. SCOT koodaa geeni OXCT1, ja sen katsotaan olevan nopeutta rajoittava vaihe ketoaineen hapetuksessa.
Tuloksemme osoittavat, että mikroglia, kuten neuronit, astrosyytit ja oligodendrosyytit, omaavat entsymaattisen aktiivisuuden ketoaineiden hapettamiselle. Useat tutkimukset ovat raportoineet ikään, lajeihin ja aivojen alueeseen liittyvistä eroista entsyymiaktiivisuudessa, joka liittyy ketoaineiden hapettumiseen. Ketoaineiden hapettumisen (ketolyysin) säätelystä tiedetään vähän.
Solutasolla ketogeneesiä ohjaa säätelyverkko, johon osallistuvat AMPK, mTOR ja PPARa.
Yhteenvetona voidaan todeta, että tutkimus antoi uusia tietoja, jotka selittävät betahydroksibutyraatin toimintaa mikroglia-solulinjoissa. Osoitamme myös, kuinka β-hydroksibutyraatti lisää tunnettujen immunomoduloivien (immuunijärjestelmää säätelevien) metaboliittien tasoa näissä malleissa. Synteettisissä gliooma-hiirimalleissa ketogeeninen ruokavalion ja sädehoidon yhdistelmä johti kasvaimen täydelliseen hävittämiseen, mikä viittaa siihen, että ketogeeninen ruokavalio ohjaa immuunijärjestelmän toimintaa.