Sukupuolen ja vanhenemisen vaikutus koronainfektioon
Tiziana Ciarambino, Ombretta Para, and Mauro Giordano
Saatteeksi
COVID-19-taudin vakavuudessa on havaittu sukupuolten välisiä eroja. Tämän katsauksen tarkoituksena on selvittää eroja COVID-19-infektion tuottamassa immuunivasteessa. Tutkimuskatsauksessa siteeratut tutkimukset on julkaistu PubMed-tietokannassa ennen 30. lokakuuta 2020.
Naisilla on miehiin verrattuna enemmän tulehdus-, virus- ja vasta-ainevälitteisiä immuunivasteita. Estrogeenin uskotaan lievittävän SARS-COV-2 -taudin oireita. Miehillä testosteroni heikentää rokotusvastetta ja lisää tulehduksellista sytokiinivastetta. Iäkkäillä potilailla ja erityisesti vanhemmilla naispotilailla immuunijärjestelmän toiminnallisen heikkenemisen on raportoitu kehittyvän asteittain.
Keskeiset huomiot:
- Naisilla on parempi vastustuskyky viruksille, bakteereille, sienille ja loisille kuin miehillä.
- Naisten luontaisen (innate) immuunijärjestelmän vaste patogeeneille on parempi kuin miehillä.
- Naisilla muodostuu vähemmän tulehdusvälittäjäaineita ja enemmän immuunijärjestelmän toimintaa sääteleviä ja tulehduksia hillitseviä molekyylejä.
- Naisten parempi suoja virus- ja mikrobi-infektioita vastaan johtuu X-kromosomista ja sukupuolihormoneista, jotka moduloivat luontaisen ja adaptiivisen immuunijärjestelmän toimintaa.
- COVID-19 infektioon sairastuneiden naisten korkeat estrogeenipitoisuudet vähentävät vakavan sairauden ja kuolleisuuden riskiä luontaisen ja vasta-ainevälitteisen immuunijärjestelmän välityksellä.
- Miesten vakavan koronainfektion ja siihen liittyvän kuoleman riski on korkeampi kuin naisilla.
- COVID-19 infektion vakavuus assosioituu tulehdusta välittävien sytokiinien ja immuunisolujen pitoisuuksiin.
Johdanto
Maailman terveysjärjestö (WHO) määritteli uuden SARS-CoV-2-koronaviruksen aiheuttaman taudin pandemiaksi 11. maaliskuuta 2020. Tartunnan saaneiden ikä vaihtelee 4 viikon ikäisestä yli 90 vuoteen. Tartuntoja on kuitenkin havaittu vähän lapsilla ja imeväisillä. [1]
Miehillä esiintyvien tartuntojen osuus on 59–68% rekisteröidyistä tartunnoista [2]. Miesten koronakuolleisuus on naisia korkeampi. Yli 75-vuotiailla potilailla on usein iän heikentämä immuunijärjestelmä, minkä seurauksena he ovat alttiimpia infektioille ja niiden aiheuttamille komplikaatioille [3,4].
COVID-19-potilaiden kuolleisuus on naisilla 2,8% ja miehillä 4,7% [5]. Italiassa miespotilaiden osuus koronaan kuolleista on 65% kaikista koronainfektion aiheuttamista kuolemantapauksista. [6]. Miesten riski kuolla koronaan on 1,79-kertainen naisiin verrattuna [7]. Jokaista koronaan kuollutta naista kohden koronaan on kuollut 1,5-2 miestä [8].
Immuunivasteen laatu ja laajuus voivat vaihdella miehillä ja naisilla, ennen ja jälkeen naisen vaihdevuosien sekä iäkkäillä aikuisiin ja lapsiin verrattuna. Naisten immuunivaste on vahvempi ennen vaihdevuosia kuin vaihdevuosien jälkeen, mutta yleensä vahvempi kuin lapsilla ja miehillä [9].
COVID-19-infektion sukupuolieroihin vaikuttavat monet tekijät, kuten genetiikka, elämäntapaerot, samanaikaiset sairaudet, hormonit, immuunijärjestelmä ja ikääntyminen [10,11].

Immuunivasteen erot sukupuolen mukaan
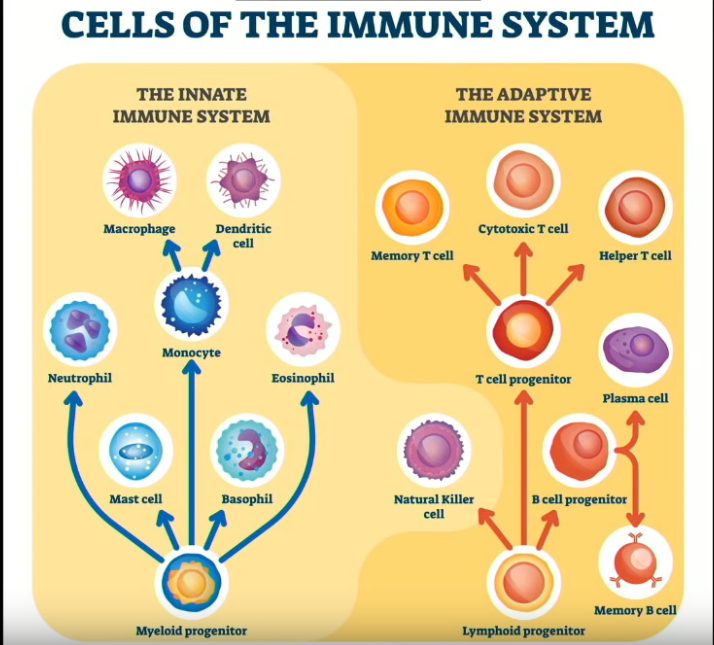
Sukupuolihormoneilla (testosteronilla ja estrogeenillä) on erilainen rooli immuunivasteissa [12]. Estrogeenireseptoreita (ERα ja ERβ) ekspressoidaan useissa immuunisoluissa (T- ja B-lymfosyytit, luonnolliset tappajasolut, makrofagit, dendriittisolut (DC) ja neutrofiilit).
Estrogeeni estää T- ja B -solujen lymfopoieesin (lymfosyyttien muodostumisen), aktivoi B -soluja ja vaikuttaa T -solujen kehitykseen. Estrogeeni säätelee useita sytokiinejä (kuten interleukiini (IL) -1, IL-10 ja interferoni-y (INFγ)), jotka osallistuvat immuunivasteteen säätelyyn. Vaikka estrogeenillä on immuunijärjestelmää stimuloivia rooleja, progesteroni ja androgeenit tukahduttavat immuunijärjestelmän ja estävät estrogeenin vaikutuksen alaisia reittejä.
Progesteroni lisää erityisesti IL-4:ää, vähentää IFN-y T-auttajasolutyypin 1 (Th1) vasteita ja vähentää T-solujen lisääntymistä sekä T-soluista riippuvaisia vasta-ainevasteita. CD8 T-soluissa progesteroni vähentää IFN-y:tä ja sytotoksisuutta.
|
Keltarauhashormoni eli progesteroni on naissukupuolihormoni, jota erittyy keltarauhasesta ja istukasta. Se muokkaa estrogeenin myötävaikutuksella kohdun limakalvoa kuukautiskierron lopulla ja raskauden aikana sikiön kasvulle sopivaksi. |
Androgeeneilla on immuunivastetta estävä vaikutus. Testosteroni voi altistaa miehet laajalle levinneelle COVID-19-infektiolle. Alhaiset seerumin T -lymfosyyttien tasot kasvattavat miesten ja erityisesti ikääntyneiden miesten riskiä sairastua vakavampaan koronainfektioon ja kuolla COVID-19-tautiin.
Sukupuolihormonit voivat vaikuttaa immuunisolujen toimintaan vaikuttamalla immuunisolujen määrään [12]. Ikääntyminen muuttaa sukupuoleen liittyvää immuuniprofiilia mm. hormonitasojen laskun vaikutuksesta [16].
|
Androgeenit eli mieshormonit ovat molemmilla sukupuolilla esiintyviä sukupuolihormoneihin kuuluvia steroidihormoneja, jotka aiheuttavat molemmille sukupuolille miehisinä pidettyjä piirteitä ja käynnistävät poikien sukupuolitunnusmerkkien kehittymisen. Androgeeneja muodostuu molemmilla sukupuolilla lisämunuaisen kuorikerroksessa. Naisilla myös munasarjat erittävät jonkin verran androgeenejä. Androgeeneillä on tärkeä anabolinen eli kehoa rakentava vaikutus läpi elämän. |
Immuunivasteen erot eri ikäisillä
Ikääntyminen vaikuttaa immuunivasteeseen. Myös immuunijärjestelmä vanhenee ikääntymisen vaikutuksesta (immunosenesenssi). Yksi ikääntyvän immuunijärjestelmän piirre on kroonisesti heikko tulehdusta edistävä tila.
Yksi ikääntyvän immuunijärjestelmän keskeisistä muutoksista liittyy kroonisesti heikentyneeseen tulehdusta edistävään tilaan. Tämän vaikutus on suurempi naisilla kuin miehillä [17]. Ilardi et al. [18] havaitsi, että sukupuoli ja ikääntyminen ovat COVID-19-infektion riskitekijöitä. Erityisesti immuunijärjestelmän ikääntyminen on tärkeä tekijä ikääntyneiden COVID-19-alttiuden kasvulle sekä heikentyneille rokotusvasteille.
Fysiologiseen ikääntymiseen liittyy subkliininen, systeeminen ja krooninen matala-asteinen tulehdus, jolle on tunnusomaista akuutin vaiheen proteiinien (CRP, C-reaktiivinen proteiini) ja tulehdusta edistävien sytokiinien (TNF-α, IL-6 ja IL-8) lisääntyminen [21, 22, 23]. Ikääntymisen seurauksena ihmisillä havaitaan muutoksia solujen rakenteessa ja solujen toiminnassa [18,24].
Vanhemmilla naispotilailla (> 65 -vuotiaat) havaitaan lisääntynyt T- ja B -solujen esiintyvyys, kun iäkkäillä miehillä vasta-ainevälitteiseen immuniteettiin osallistuvien B-solujen (CD19+) määrät olivat selvästi matalammat [26, 27]. Tutkimuksissa on havaittu iän vaikuttavan CD27+ B-muistisolujen määrään [28]. Immunoglobuliini M (IgM) B-muistisolujen esiintymistiheys oli vähentynyt [29] tai ennallaan ikääntymisen seurauksena [30], mutta ikääntyminen liittyi selvästi heikompaan vasta-aineiden eritykseen.
CD8+ T-solut puhdistavat elimistöstä virustartunnan saaneita soluja [32] ja edistävät virusspesifisten vasta-aineiden [33] tuotantoa. Nämä immunologiset tekijät estävät solunulkoisia viruksia infektoimasta soluja [34]. Naiivien T -solujen määrä kuitenkin laskee ikääntyneillä. CD8+ T-solujen vähenemistä havaittiin sekä miehillä että naisilla [35].
T-solujen väheneminen liittyy toiminnallisten epiteelisolujen asteittaiseen korvaamiseen rasva- ja arpikudoksella [36], kateenkorvan surkastumiseen (involuutio) ja T-solujen immunosenesenssiin (immuunijärjestelmän heikkenemiseen vanhenemisen seurauksena) [37].
Kaiken ikäisillä naisilla havaitaan miehiin verrattuna tehokkaammin toimiva kateenkorva [38]. Immunosenesenssiin liittyy myös: ikääntyneen immuunijärjestelmän vähentynyt luonnollisten tappajasolujen sytotoksisuus (NKCC), lyyttisen aktiivisuuden heikkeneminen ja sytokiini- ja kemokiinituotannon väheneminen [39].
Beyer et al. [40] raportoi, että 18–64 -vuotiaille naisille kehittyy vahvempi vasta-ainevaste pienemmällä rokoteannoksella. Naisten puolikkaasta influenssarokotusannoksesta saama immuunivaste vastaa miesten koko rokotusannoksesta saamaa vasta -ainevasetta.
Wang et al. [41] osoitti, että vanhemmilla naisilla influenssarokotukset assosioituvat miehiin verrattuna alhaisempaan sairaalahoidon tarpeeseen ja kuolleisuuteen.
Miehillä havaittu ikääntymiseen liittyvä asteittainen testosteronipitoisuuden lasku voi edistää soluvaurioita ja tulehduksia [42].

COVID-19 ja immuunijärjestelmä
COVID-19-infektion kliiniset oireet voivat johtua synnynnäisen immuunivasteen ja viruksen aiheuttamien suorien sytopaattisten vaikutusten yhdistelmästä kun adaptiivinen immuunivaste ei pysty poistamaan virusta.
Vakavissa COVID-19-infektioissa potilailla on merkittävästi korkeampia tulehdusta edistävien sytokiinien ja kemokiinien pitoisuuksia plasmassa sekä samanaikaisesti heikentynyt T-solu- ja vasta-ainevaste [43]. Sytokiinien (esim. IL-6) määrän lisääntymisestä on päätelty, että luontaisen immuunijärjestelmän aiheuttama ”sytokiinimyrsky” on tärkein syy COVID-19-infektion aiheuttamiin hengenvaarallisiin oireisiin, kuten hengityksen lamaantumiseen ja elimellisiin vaurioihin [44].
Myös immuunivasteen sääntelyn heikentyminen liittyy infektion vakavuuteen [45].
Taudin vakavuus assosioituu usein T-solujen pitoisuuden laskuun veressä [45]. Miehillä ikääntymiseen liittyvä tulehdusvaste (inflamm-aging) on yleensä voimakkaampi kuin naisilla.
|
Inflamm-aging/inflammaging: Tulehduksellinen ikääntyminen tarkoittaa kroonista matala-asteista tulehdusta, joka kehittyy iän myötä. Sen uskotaan nopeuttavan biologisen ikääntymisen prosessia ja pahentavan monia ikääntymiseen liittyviä sairauksia. Immuunijärjestelmä heikkenee ihmisen vanhetessa. Tämä vaikuttaa adaptiivisen immuunijärjestelmän toimintaa heikentävästi. Immuunijärjestelmän tuottamien lymfosyyttien määrä vähenee ja kypsien lymfosyyttien koostumus ja laatu muuttuvat. Kun adaptiivisen immuunijärjestelmän tehokkuus heikkenee, synnynnäisten (innate) immuunimekanismien aktivaatio lisääntyy. Tähän liittyy suurempi määrä luonnollisia tappajasoluja (NK) ja lisääntynyt tulehdusta edistävien sytokiinien tuotanto. Synnynnäisen immuunijärjestelmän aktivaatio heikentää tulehduksen kehittymistä vanhuksilla. Tulehdus määritellään matala -asteiseksi, krooniseksi, kontrolloiduksi ja oireettomaksi tulehdukseksi, joka ilmenee ilman infektiota ja johtuu pääasiassa endogeenisistä signaaleista. Tulehdusvasteen ikääntymiseen liittyviä avainmolekyylejä ovat kohonneet tulehdusta edistävät sytokiinit, erityisesti IL-6, TNFα ja C-reaktiivinen proteiini (CRP). Tämä krooninen tulehdustila vaikuttaa haitallisesti terveyteen, edistää biologista ikääntymistä ja ikään liittyvien patologioiden kehittymistä. Inflamm-aging vaikuttaa mm. Alzheimerin taudin, ateroskleroosin, tyypin II diabeteksen ja kroonisten sydäntautien kehittymiseen ja niiden etenemiseen. On arveltu, että yksi syy tulehdusreaktion ikääntymiseen on vaurioituneista soluista kertyvien väärin sijoitettujen ja väärin toimivien autoreaktiivisten molekyylien kumuloituminen kehoon. Nämä molekyylit tunnistavat synnynnäisten immuunisolujen reseptorit, mikä johtaa niiden aktivoitumiseen ja edelleen tulehdukseen. Solukomponentteja, jotka voivat stimuloida synnynnäisiä soluja, ovat mikroRNA:t, mitokondrioiden DNA ja histonit. Ikääntyvät solut lisääntyvät vanhenemisen myötä ja erittävät tulehdusta edistävää kemikaalien sekoitusta, joka tunnetaan nimellä ikääntymiseen liittyvä eritysfenotyyppi (SASP). Tulehdusreaktion ikääntymiseen liittyy myös sytomegalovirusinfektio. Sytomegalovirus lisää useiden tulehduksellisten sytokiinien tuotantoa ja johtaa myös CMV -spesifisten T -solujen laajentumiseen. Muita mahdollisia tekijöitä, jotka voivat johtaa tulehdusreaktion ikääntymiseen, ovat aliravitsemus, muuttunut suoliston mikrobiomi, heikentynyt suoliston epiteelisuoja ja krooninen stressi, joita voi esiintyä missä elämänvaiheessa tahansa. Myös rasvakudos voi erittää sytokiinejä, joilla on tulehduksellisia ominaisuuksia. |
Vanhenevien solujen kumuloituminen voi selittää tulehduksen lisääntymistä keuhkoissa [46]. COVID-19 vaikuttaa elinvaurioihin, ja se voi infektoida endoteelisoluja ja kiertää verenkierrossa elimistön läpi [47]. COVID-19-potilaiden keuhkoista on todettu vakavia endoteelivaurioita [48,49] Siten vanhentuneiden solujen lisääntynyt läsnäolo voi altistaa vakavan COVID-19: n kehittymiselle seuraavilla kahdella ehdolla:
- Heikentynyt immuunisolujen poistuminen [50].
- Kasvava viruskuorma
Naiset ja virusinfektiot
Naiset sairastuvat suhteessa useammin autoimmuunisairauksiin, kun taas miehet ovat alttiimpia tartuntataudeille [11]. Eroja havaitaan sairauksien vakavuuden ja esiintyvyyden suhteen [51]
Todennäköisesti naisten alttiuden vähentyminen virusinfektioille johtuu X-kromosomin ja sukupuolihormonien suojaavasta vaikutuksesta [51]. Immuunivaste virusinfektioille on erilainen naisilla ja miehillä [11]. Tutkimuksissa on havaittu, että naisilla on virusinfektioiden aikana suurempi tulehdus-, virus- ja humoraalinen immuunivaste kuin miehillä [52], Steroideilla voi olla ratkaiseva rooli tulehdussolujen toiminnassa ja immuunivasteen säätelyssä [53]. Steroidit säätelevät seuraavia toimia:
- Androgeenireseptoreihin vaikuttavia immuunitoimintoja hillitsevä rooli [54].
- Tukahduttaa immuunisolujen toimintaa vähentämällä tulehdusta ja edistämällä anti-inflammatorisia välittäjiä [54].
Nämä vasteet auttavat parantamaan virusten, kuten SARS-CoV-2, hävittämistä naispotilailla. Havainnot tukevat tutkimuksia, joissa naisilla todettiin miehiä korkeampia vasta -ainetasoja [55]. Testosteroni heikentää rokotusvastetta, kun taas estrogeeni voi auttaa SARS-COV-2 -infektion torjunnassa [56-58].
ACE-2 ja sukupuolierot
SARS-CoV-2 infektoi soluja kiinnittymällä solujen ACE2-reseptoreihin. Angiotensiiniä tuottavan entsyymi 2 (ACE-2) on COVID-19-tartunnan ensisijainen reitti. Se sijaitsee X -kromosomissa. Naisilla voi olla enemmän ACE2-entsyymiä. Sitä ilmenee keuhkoissa, munuaisissa, sydänlihaksessa, ruoansulatuskanavassa ja lisääntymiselimissä.
Edelleen on epäselvää, miksi ACE-2:n suurempi ilmentyminen naispotilailla ei assosioidu vakaviin infektiotapauksiin ja huonompaan taudin ennusteeseen. ACE-2, joka edustaa infektioreittiä, aiheuttaa myös useita immunomoduloivia vaikutuksia, jotka voivat selittää vähemmän vakavia kliinisiä oireita.
ACE2-entsyymin vaikutukset eivät vaikuta pelkästään angiotensiini I:n konversioon, vaan myös immunomodulaatioon (immuunijärjestelmän säätelyyn) ja keuhkovaurioiden ehkäisyyn, joilla on naispotilaita suojaava vaikutus [59].

Mitä rokotuksista tiedetään?
Tehokas rokote on paras pitkäaikainen suoja COVID-19-infektiolta. Kaksi ensisijaista tekijää COVID -rokotteen tehokkuuden määrittämiseksi ovat seuraavat:
- Serokonversion määrittelemä suoja infektiolta. (Serokonversio tarkoittaa spesifisten vasta-aineiden kehittymistä veriseerumissa infektion tai immunisoinnin seurauksena. Kun serokonversio on tapahtunut, vasta-aineet voidaan havaita taudin verikokeissa.)
- Vakavia kliinisiä oireita estävä vaikutus.
Rokotukset ovat tarpeellisia tartuntaketjujen katkaisemiseksi ja epidemian tukahduttamiseksi. Ne täydentävät antiviraalista hoitoa virusten aiheuttamien epidemioiden hallinnassa. COVID-19-rokotteessa on keskeistä isäntä-koronavirus-vuorovaikutus ja suojaava immuunimekanismi [60].
Cocktail-rokotestrategia voi indusoida immuniteetin, joka suojaa isäntää S-ACE2-vuorovaikutukselta estämällä viruksen pääsyn isäntäsoluihin. Tämä voi suojata muita ei-rakenteellisia adhesiiniproteiineja (esim. Nsp3) vastaan, mitkä edistävät solujen infektoitumista ja virusten lisääntymistä [61].
Rokotevaste sukupuolen mukaan:
331 kiinalaisen SARS-CoV-2-infektiota sairastavan potilaan tutkimus osoitti, että anti-SARS-CoV-2-immunoglobuliini G (IgG) -vasteet liittyivät sairauden vakavuuteen. Sairaudesta toipuneiden sukupuolijakauma oli: 35 % miehiä ja 65 % naisia [52]. SARS-CoV-2-vastaiset IgG-tiitterit olivat sukupuolen mukaan vastaavia potilailla, joilla oli lievä COVID-19-tauti. Vakavaa tautia sairastavilla naispotilailla oli parempi vasta -ainevaste kuin miehillä ja vasta -aineita syntyi naisilla taudin varhaisemmissa vaiheissa. Nämä tulokset ovat johdonmukaisia muiden tutkimusten kanssa, joissa naisilla havaittiin miehiä korkeampia vasta -ainetasoja (mukaan lukien enemmän toiminnallisia vasta -aineita) [62].
Voimakkaampi immuunivaste voi altistaa naiset herkemmin autoimmuunisairauksille. Vahvempi immuunivaste voi myös lisätä rokotteiden haittavaikutuksia [57]. Jotkut näistä eroista voivat liittyä hormonaalisiin eroihin, kuten estrogeeni- ja testosteronitasoihin [56].
On raportoitu, että testosteroni heikentää rokotusvastetta [58].
Päätelmä
Virusinfektioon liittyvä inflammaation lisääntyminen ikääntyneillä assosioituu ylireagoivaan immuunivasteeseen, joka kasvattaa vakavan sairauden, keuhko- ja muiden elinten vaurioiden sekä kuolleisuuden riskiä.
COVID-19-tutkimukset osoittavat, että immuunijärjestelmällä on ratkaiseva rooli taudin vakavuuden määrittymisessä. Korkeammat anti-S- ja anti-N-IgG- ja IgM-tiitterit assosioituvat vakavampiin kliinisiin oireisiin ja potilaan ikään [63], mikä viitta vasta-aineiden mahdollisesti haitallisiin vaikutuksiin joillain potilailla.

Artikkelin lähdeaineisto
Lähde: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8188967/
1. Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Infect Dis 2020; 20(5): 533–553. [PMC free article] [PubMed] [Google Scholar]
2. Yu Y, Shi Q, Chen H. Clinical trial analysis of 2019-nCoV therapy registered in China. J Med Virol 2020; 92(7): 711–712. [PMC free article] [PubMed] [Google Scholar]
3. Guzik TJ, Mohiddin SA, Dimarco A, et al.. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res 2020; 116(10): 1666–1687. [PMC free article] [PubMed] [Google Scholar]
4. Li X, Geng M, Peng Y, et al.. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020; 10(2): 102–108. [PMC free article] [PubMed] [Google Scholar]
7. Gebhard C, Regitz-Zagrosek VR, Neuhauser HK, et al.. Impact of sex gender on Covid-19 outcomes in Europe. Biol Sex Diff 2020; 11: 29. [PMC free article] [PubMed] [Google Scholar]
9. Giefing-Kroll C, Berger P, Lepperdinger G, et al.. How sex and age affect immune responses, susceptibility to infections, and response to vaccination. Aging Cell 2015; 14(3): 309–321. [PMC free article] [PubMed] [Google Scholar]
10. Bartz D, Chitnis T, Kaiser UB, et al.. Clinical advances in sex-and gender-informed medicine to improve the health of all: A review. JAMA Int Med 2020; 180: 574–583. [PubMed] [Google Scholar]
11. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016; 16(10): 626–638. [PubMed] [Google Scholar]
12. Klein SL, Marriott I, Fish EN. Sex-based differences in immune function and responses to vaccination. Trans R Soc Trop Med Hyg 2015; 109(1): 9–15. [PMC free article] [PubMed] [Google Scholar]
13. Moulton VR. Sex hormones in acquired immunity and autoimmune disease. Frontiers Immun 2018; 9: 2279. [PMC free article] [PubMed] [Google Scholar]
14. Ortona E, Pierdominici M, Rider V. Editorial: Sex hormones and Gender differences in immune responses. Front Immunol 2019; 10: 1076. [PMC free article] [PubMed] [Google Scholar]
15. Giagulli VA, Guastamacchia E, Magrone T, et al.. Worse progression of COVID-19 in men: Is testosterone a key factor? Andrology 2021; 9(1): 53–64. [PMC free article] [PubMed] [Google Scholar]
16. Márquez EJ, Chung CH, Marches R, et al.. Sexual-dimorphism in human immune system aging. Nat Commun 2020; 11(1): 751. [PMC free article] [PubMed] [Google Scholar]
17. Fink AL, Klein SL. Sex and gender impact immune responses to vaccines among the elderly. Physiology 2015; 30(6): 408–416. [PMC free article] [PubMed] [Google Scholar]
18. Ilardi A, Politi C, Ciarambino T. COVID-19: Could sex and age be a risk factor? Minerva Med. Epub ahead of print 20 July 2020. DOI: 10.23736/S0026-4806.20.06705-1. [PubMed] [CrossRef] [Google Scholar]
19. Molony RD, Malawista A, Montgomery RR. Reduced dynamic range of antiviral innate immune responses in aging. Exp Gerontol 2018; 107: 1305. [PMC free article] [PubMed] [Google Scholar]
20. Lord JM. The effect of ageing of the immune system on vaccination responses. Hum Vaccin Immunother 2013; 9(6): 1364–1367. [PMC free article] [PubMed] [Google Scholar]
21. Bartlett DB, Firth CM, Phillips AC, et al.. The age-related increase in low-grade systemic inflammation (Inflamm-aging) is not driven by cytomegalovirus infection. Aging Cell 2012; 11(5): 912–915. [PubMed] [Google Scholar]
22. Franceschi C, Bonafe M, Valensin S, et al.. Inflamm-aging. An evolutionary perspective on immunosenescence. Ann N Y Acad Sci 2000; 908: 244–254. [PubMed] [Google Scholar]
23. Hazeldine J, Lord JM. Immunesenescence: a predisposing risk factor for the development of COVID-19? Front Immunol 2020; 11: 573662. [PMC free article] [PubMed] [Google Scholar]
24. Ucar D, Marquez EJ, Chung CH, et al.. The chromatin accessibility signature of human immune aging stems from CD8(+) T cells. J Exp Med 2017; 214(10): 3123–3144. [PMC free article] [PubMed] [Google Scholar]
25. Bienvenu LA, Noonan J, Wang X, et al.. Higher mortality of COVID-19 in males: sex differences in immune response and cardiovascular comorbidities. Cardiovas Res 2000; 116: 2197–2206. [PMC free article] [PubMed] [Google Scholar]
26. Hirokawa K, Utsuyama M, Hayashi Y, et al.. Slower immune system aging in women versus men in the Japanese population. Immun Ageing 2013; 10(1): 19. [PMC free article] [PubMed] [Google Scholar]
27. Ademokun A, Wu YC, Dunn-Walters D. The ageing B cell population: composition and function. Biogerontology 2010; 11(2): 125–137. [PubMed] [Google Scholar]
28. Veneri D, Ortolani R, Franchini M, et al.. Expression of CD27 and CD23 on peripheral blood B lymphocytes in humans of different ages. Blood Transfus 2009; 7(1): 29–34. [PMC free article] [PubMed] [Google Scholar]
29. Shi Y, Yamazaki T, Okubo Y, et al.. Regulation of aged humoral immune defense against pneumococcal bacteria by IgM memory B cell. J Immunol 2005; 175: 3262–3267. [PubMed] [Google Scholar]
30. Frasca D, Landin AM, Lechner SC, et al.. Aging down-regulates the transcription factor E2A, activation-induced cytidine deaminase, and Ig class switch in human B cells. J Immunol 2008; 180: 5283–5290. [PubMed] [Google Scholar]
31. Frasca D, Nguyen D, Riley RL, et al.. Effects of aging on proliferation and E47 transcription factor activity induced by different stimuli in murine splenic B cells. Mech Ageing Dev 2003; 124(4): 361–369. [PubMed] [Google Scholar]
32. Channappanavar R, Fett C, Zhao J, et al.. Virus-specific memory CD8 T cells provide substantial protection from lethal severe acute respiratory syndrome coronavirus infection. J Virol 2014; 88: 11034–11044. [PMC free article] [PubMed] [Google Scholar]
33. Channappanavar R, Zhao J, Perlman S. T cell-mediated immune response to respiratory coronaviruses. Immunol Res 2014; 59: 118–128. [PMC free article] [PubMed] [Google Scholar]
34. Sok D, Burton DR. Recent progress in broadly neutralizing antibodies to HIV. Nat Immunol 2018; 19(11): 1179–1188. [PMC free article] [PubMed] [Google Scholar]
35. Olson NC, Doyle MF, Jenny NS, et al.. Decreased naive and increased memory CD4(+) T cells are associated with subclinical atherosclerosis: the multi-ethnic study of atherosclerosis. PLoS ONE 2013; 8(8): e71498. [PMC free article] [PubMed] [Google Scholar]
36. Yang H, Youm YH, Sun Y, et al.. Axin expression in thymic stromal cells contributes to an age-related increase in thymic adiposity and is associated with reduced thymopoiesis independently of ghrelin signaling. J Leukoc Biol 2009; 85(6): 928–938. [PMC free article] [PubMed] [Google Scholar]
37. Fagnoni FF, Vescovini R, Passeri G, et al.. Shortage of circulating naive CD8(+) T cells provides new insights on immunodeficiency in aging. Blood 2000; 95: 2860–2868. [PubMed] [Google Scholar]
38. Clave E, et al.. Human thymopoiesis is influenced by a common genetic variant within the TCRA-TCRD locus. Science Translational Med 2018; 10(457): eaao296. [PubMed] [Google Scholar]
39. Mariani E, Pulsatelli L, Meneghetti A, et al.. Different IL-8 production by T and NK lymphocytes in elderly subjects. Mech Ageing Dev 2001; 122: 1383–1395. [PubMed] [Google Scholar]
40. Beyer WE, Palache AM, Kerstens R, et al.. Gender differences in local and systemic reactions to inactivated influenza vaccine, established by a meta-analysis of fourteen independent studies. Eur J Clin Microbiol Infect Dis 1996; 15(1): 65–70. [PubMed] [Google Scholar]
41. Wang CS, Wang ST, Chou P. Efficacy and cost-effectiveness of influenza vaccination of the elderly in a densely populated and unvaccinated community. Vaccine 2002; 20: 2494–2499. [PubMed] [Google Scholar]
42. Márquez EJ, Trowbridge J, Kuchel GA, et al.. The lethal sex gap: COVID-19. Immun Age 2020; 17: 13. [PMC free article] [PubMed] [Google Scholar]
43. Huang C, Wang Y, Li X, et al.. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497–506. [PMC free article] [PubMed] [Google Scholar]
44. Mehta P, McAuley DF, Brown M, et al.. COVID-19: Consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395: 1033–1103. [PMC free article] [PubMed] [Google Scholar]
45. Qin C, Zhou L, Hu Z, et al.. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin Infect Dis 2020; 71: 762–768. [PMC free article] [PubMed] [Google Scholar]
46. Parikh P, Wicher S, Khandalavala K, et al.. Cellular senescence in the lung across the age spectrum. Am J Physiol Lung Cell Mol Physiol 2019; 316: L826–L842. [PMC free article] [PubMed] [Google Scholar]
47. Varga Z, Flammer AJ, Steiger P, et al.. Endothelial cell infection and endotheliitis in COVID-19. Lancet 2020; 395: 1417–1141. [PMC free article] [PubMed] [Google Scholar]
48. Ackermann M, Verleden SE, Kuehnel M, et al.. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 2020; 383: 120–112. [PMC free article] [PubMed] [Google Scholar]
49. Beacon TH, Su RC, Lakowski TM, et al.. SARS-CoV-2 multifaceted interaction with the human host. Part II: Innate immunity response, immunopathology, and epigenetics. IUBMB Life 2020; 72: 2331–2354. [PubMed] [Google Scholar]
50. Vukmanovic-Stejic M, Chambers ES, Suarez-Farinas M, et al.. Enhancement of cutaneous immunity during aging by blocking p38 mitogen-activated protein (MAP) kinase-induced inflammation. J Allergy Clin Immunol 2018; 142(3): 844–856. [PMC free article] [PubMed] [Google Scholar]
51. vom Steeg LG, Klein SL. SeXX matters in infectious disease pathogenesis. PLoS Pathog 2016; 12(2): e1005374. [PMC free article] [PubMed] [Google Scholar]
52. Zeng F, Dai C, Cai P, et al.. A comparison study of SARS-CoV-2 IgG antibody between male and female COVID-19 patients: a possible reason underlying different outcome between gender. medRxiv preprint, 2020, https://www.medrxiv.org/content/10.1101/2020.03.26.20040709v1 [PMC free article] [PubMed]
53. Vom Steeg LG, Attreed SE, Zirkin B, et al.. Testosterone treatment of aged male mice improves some but not all aspects of age-associated increases in influenza severity. Cell Immunol 2019; 345: 103988. [PMC free article] [PubMed] [Google Scholar]
54. Bereshchenko O, Bruscoli S, Riccardi C. Glucocorticoids, sex hormones, and immunity. Front Immunol 2018; 9: 1332. [PMC free article] [PubMed] [Google Scholar]
55. Klein SL, Jedlicka A, Pekosz A. The Xs and Y of immune responses to viral vaccines. Lancet Infect Dis 2010; 10(5): 338–349. [PMC free article] [PubMed] [Google Scholar]
56. Ruggieri A, Anticoli S, D’Ambrosio A, et al.. The influence of sex and gender on immunity, infection and vaccination. Ann Ist Super Sanita 2016; 52(2): 198–204. [PubMed] [Google Scholar]
57. Fischinger S, Boudreau CM, Butler AL, et al.. Sex differences in vaccine-induced humoral immunity. Semin Immunopathol 2019; 41(2): 239–249. [PMC free article] [PubMed] [Google Scholar]
58. Trigunaite A. Suppressive effects of androgens on the immune system. Cell Immunol 2015; 294: 87–94. [PubMed] [Google Scholar]
59. Bhatia K, Zimmerman MA, Sullivan JC. Sex differences in angiotensin-converting enzyme modulation of Ang (1–7) levels in normotensive WKY rats. Am J Hypertens 2013; 26(5): 591–598. [PMC free article] [PubMed] [Google Scholar]
60. Roper RL, Rehm KE. SARS vaccines: where are we? Expert Rev Vaccines 2009; 8: 887–898. [PMC free article] [PubMed] [Google Scholar]
61. Ong E, Wong MU, Huffman A, et al.. COVID-19 coronavirus vaccine design using reverse vaccinology and machine learning, 2020, https://www.biorxiv.org/content/10.1101/2020.03.20.000141v2 [PMC free article] [PubMed]
62. Potluri T, Fink AL, Sylvia KE, et al.. associated changes in the impact of sex steroids on influenza vaccine responses in males and females. NPJ Vaccines 2019; 4: 29. [PMC free article] [PubMed] [Google Scholar]
63. Jiang HW, Li Y, Zhang HN, et al.. Global profiling of SARS-CoV-2 specific IgG/IgM responses of convalescents using a proteome microarray. medRxi preprint, 2020, https://www.medrxiv.org/content/10.1101/2020.03.20.20039495v1
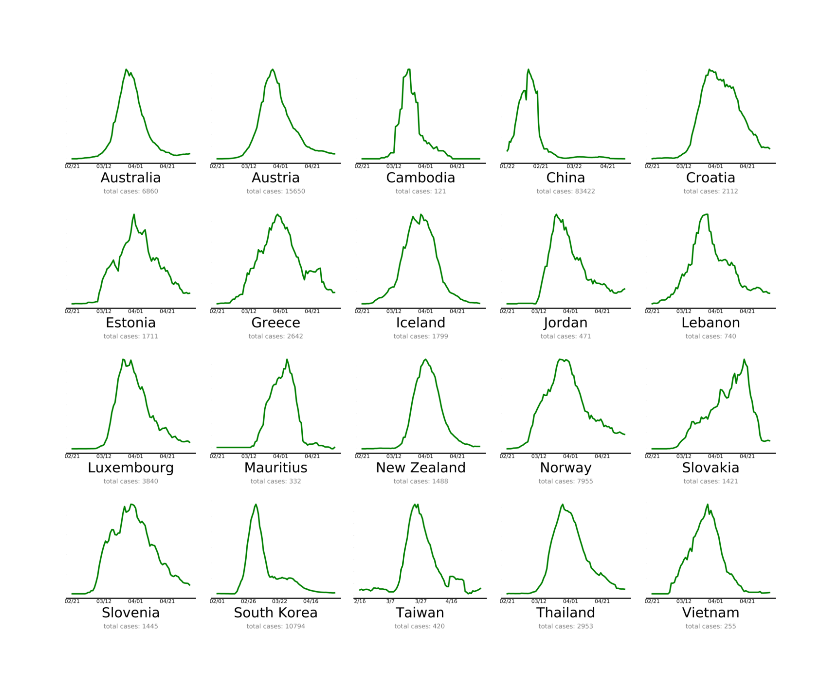 Toisessa kuvassa ovat valtiot, jotka ovat lähes tavoitteessa.
Toisessa kuvassa ovat valtiot, jotka ovat lähes tavoitteessa.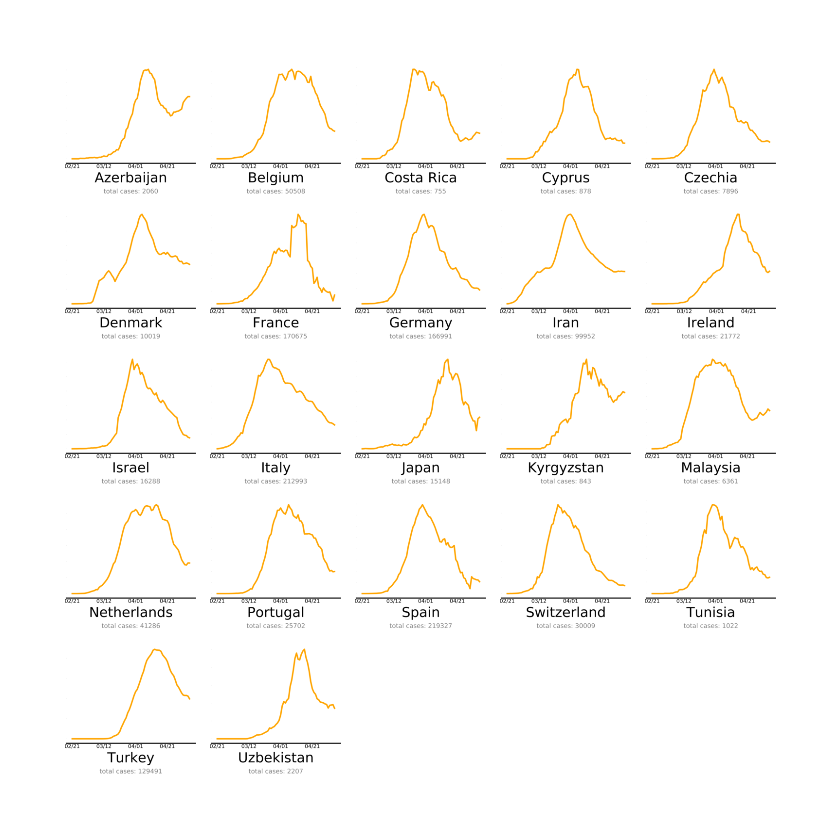 Kolmannessa ovat maat, joiden on tehtävä enemmän koronaepidemian kitkemiseksi. Tämä on viimeksi päivitetty 4.5. Miksi Suomi on huonoimmin selvinneiden kategoriassa? Luultavasti, koska taudin eteneminen ei ole lähtenyt toivotulla tavalla laskuun. Lähde:
Kolmannessa ovat maat, joiden on tehtävä enemmän koronaepidemian kitkemiseksi. Tämä on viimeksi päivitetty 4.5. Miksi Suomi on huonoimmin selvinneiden kategoriassa? Luultavasti, koska taudin eteneminen ei ole lähtenyt toivotulla tavalla laskuun. Lähde: 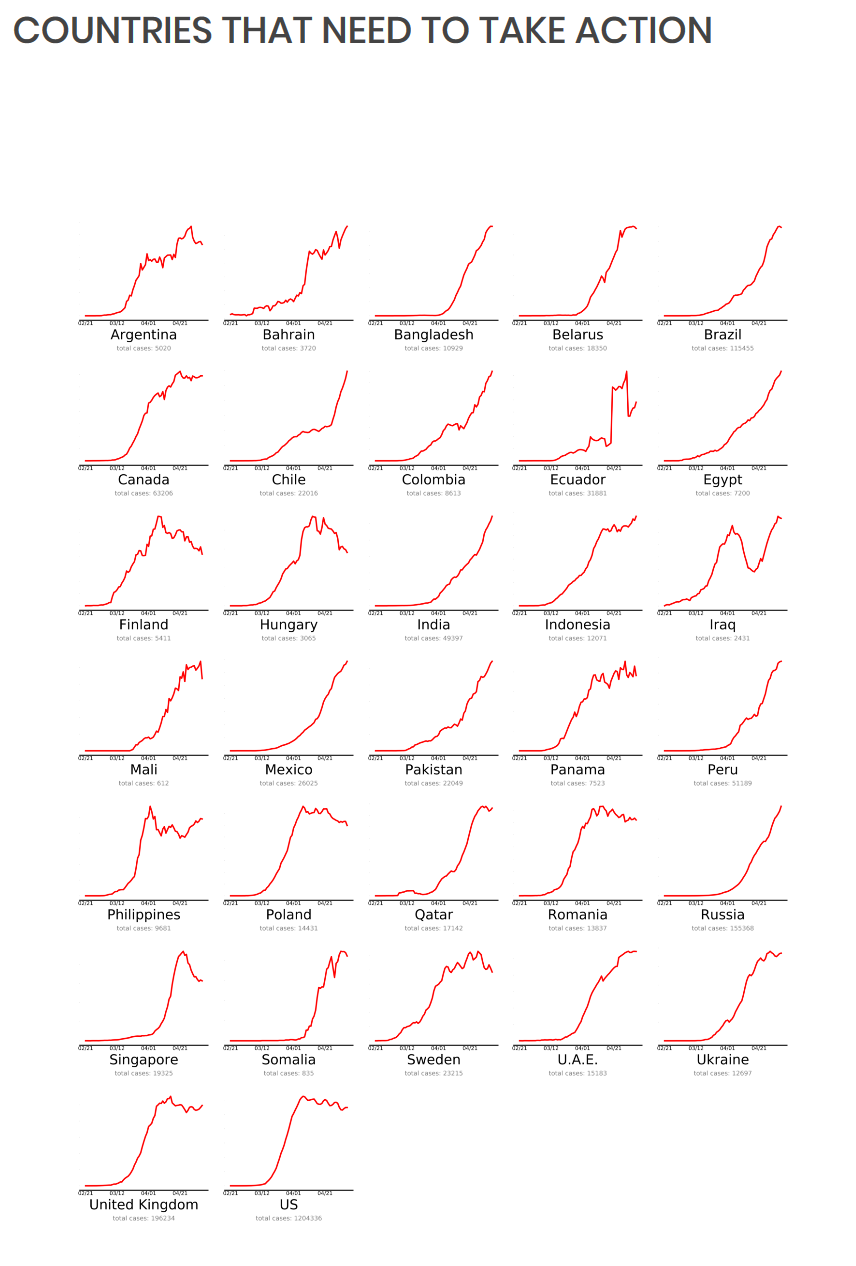









































 Juu. Kuva on Pixabaysta – ei minusta.
Juu. Kuva on Pixabaysta – ei minusta.




















 Tietenkin epidemiaa voi hoitaa myös rukoilemalla, kuten Yhdysvalloissa tehdään.
Tietenkin epidemiaa voi hoitaa myös rukoilemalla, kuten Yhdysvalloissa tehdään.










 Kävin aamulla kaupassa. Kaupan hyllyt olivat monien tuotteiden osalta tyhjät. Minut kauppaaan kuljettanut taksikuski kertoi, että hänen tulonsa ovat romahtaneet 80-90 % ensin Bernerin taksiuudistuksen ja nyt koronaepidemian vuoksi, Viimeisin isku taksikuskin mukaan oli Eläkeyhtiö Tapiolan sulkeminen koronatartunnan vuoksi. Hän valitteli, että hänen tulonsa eivät enää riitä ruokaan ja laskuihin, vaikka hän istuu autossa päivittäin jopa 15 tuntia. Asiakkaita ei vain ole.
Kävin aamulla kaupassa. Kaupan hyllyt olivat monien tuotteiden osalta tyhjät. Minut kauppaaan kuljettanut taksikuski kertoi, että hänen tulonsa ovat romahtaneet 80-90 % ensin Bernerin taksiuudistuksen ja nyt koronaepidemian vuoksi, Viimeisin isku taksikuskin mukaan oli Eläkeyhtiö Tapiolan sulkeminen koronatartunnan vuoksi. Hän valitteli, että hänen tulonsa eivät enää riitä ruokaan ja laskuihin, vaikka hän istuu autossa päivittäin jopa 15 tuntia. Asiakkaita ei vain ole.

