Infektiot ja autoimmuunitaudit osa 2: SARS-CoV-2
Koronapandemiaan reagoidaan tiedon karttuessa ja ongelmien ilmaantuessa. Näin on toimittu pandemian alusta alkaen. SARS-CoV-2-viruksen ympärillä käytävä keskustelu on polarisoitunutta ja kiivasta. Rationaalista keskustelua vesittää huolettomuuden ja lyhytnäköisyyden ohella äärimmäiset mielipiteet ja salaliittoteoriat.
Koronainfektion mahdollisista pitkäaikaisvaikutuksista keskustellaan vielä melko vähän. Keskustelu näyttää kangistuneen paikoilleen: yhtäällä mRNA- ja adenovirusvektorirokotusten mahdollisiin haittavaikutuksiin ja toisaalla tartuntatilastoihin, potilasmääriin ja koronan aiheuttamiin kuolemantapauksiin.
Koronapandemian vastaisia toimia vähätellään, koska vakavasti sairastuneet ja koronaan kuolevat ovat a) lihavia, b) vanhoja ja c) monisairaita, jotka kuolisivat pian muutenkin. Tällainen ajattelu on mielestäni vastenmielistä.
Monilta asiaa kommentoivilta näyttää unohtuvan, että patogeenit voivat vaikeuttaa elämää pitkään varsinaisen infektion jälkeen. Myös lapsille ja nuorille voi kehittyä kroonistuvia oireita. Toistaiseksi SARS-CoV-2 on niin uusi virus, että sen mahdollisia kroonistuvia oireita ei vielä tunneta. Sellaisiin on hyvä varautua. Autoimmuunitaudit kehittyvät yleensä hitaasti ja paljastuvat vuosien tai vuosikymmenten jälkeen.
Kirjoitin patogeenien vaikutuksesta autoimmuunitautien syntymekanismiin laajan ja teknisemmän tutkielman (lue tästä). Tässä tarkastelen SARS-CoV-2-viruksen yhteyttä autoimmuunitautien kehittymiseen hieman yleisemmin ja kansantajuisemmin.
Mitä koronainfektion pitkäaikaisvaikutuksista tiedetään?
Tuore tutkimus havaitsi, että monilla COVID-19-tartunnan saaneilla elimistö tuottaa immuunivasteita kehon omia kudoksia vastaan. Britannian Coronavirus Immunology Consortiumin rahoittamaa tutkimusta johti Birminghamin yliopisto.
Tutkimuksessa selvitettiin yleisten autovasta-aineiden esiintymistiheyttä ja tyyppejä 84 potilaalla, joilla oli testaushetkellä joko vakava COVID-19, tai he olivat toipumassa koronainfektiosta. Näitä tuloksia verrattiin kontrolliryhmään, jossa oli 32 tehohoitopotilaasta, jotka olivat hoidossa jonkin muun syyn vuoksi.
Tutkimuksen tulokset julkaistiin Clinical & Experimental Immunology -lehdessä. COVID-19-tautiin liittyy erilaisia odottamattomia oireita sekä tartunnan aikaan että pitkään sen jälkeen. Näiden oireiden syytä ei vielä täysin ymmärretä, mutta on hyvin mahdollista, että COVID-19 laukaisee autoimmuuniprosessin, jossa immuunijärjestelmä suuntautuu väärin ja hyökkää elimistön omia kudoksia vastaan.
SARS-CoV-2 voi laukaista autoimmuunisairauksia
Autovasta-aineet ovat immuunijärjestelmän tuottamia vasta-aineita, joka suuntautuvat yhtä tai useampaa elimistön omaa proteiinia vastaan. Ne voivat laukaista prosessin, jonka seurauksena on jokin autoimmuunitauti.
Infektio voi joissakin olosuhteissa johtaa autoimmuunisairauden kehittymiseen. On saatu viitteitä siitä, että SARS-CoV-2-infektio liittyy sairauksiin, kuten Guillain-Barren oireyhtymä.
Yhdistyneen kuningaskunnan tutkimuksen ja innovoinnin (UKRI) ja kansallisen terveystutkimuslaitoksen (NIHR) tukemassa tutkimuksessa vahvistettiin, että COVID-19-potilailla esiintyi enemmän autovasta-aineita kuin kontrolliryhmässä ja että autovasta-aineet säilyivät elimistössä jopa kuusi kuukautta.
Potilailla, jotka eivät sairastaneet koronainfektiota havaittiin erityyppisiä auto-vasta-aineita kuin koronainfektiota sairastavilla. COVID-19-ryhmissä auto-vasta-aineet liittyivät ihoon, ihaksiin ja sydämeen.
Tutkijat ovat osoittaneet, että vakavamman COVID-19-infektion sairastaneiden veressä on todennäköisemmin autovasta-ainetta kuin lievemmän infektion sairastaneilla. Tämä havainto tukee rokotuskampanjaa siinäkin tapauksessa, että deltavariantti tarttuu myös rokotettuihin. Näin siksi, että rokote ehkäisee tehokkaasti sairaalahoitoa vaativaa vakavampaa COVID-19-infektiota.
Professori Alex Richter, Birminghamin yliopistosta kertoi, että tunnistetut vasta -aineet ovat samanlaisia kuin ne, jotka aiheuttavat eräitä ihon, lihasten ja sydämen autoimmuunisairauksia. Hän painotti, että vielä ei tiedetä aiheuttavatko autovasta-aineet aina oireita potilaille tai liittyykö havaittu ilmiö yleisemmin infektion sairastamiseen.
Professori David Wraith Birminghamin yliopistosta korosti, että tässä yksityiskohtaisessa tutkimuksessa, jossa tutkittiin useita eri kudoksia, vahvistettiin, että COVID-19-infektio liittyy spesifien auto-vasta-aineiden tuotantoon. (1)
Havaintojen mukaan COVID-19 voi laukaista autoimmuunisairauden (2)
Tutkimukset osoittavat, että COVID-19 voi aiheuttaa autoimmuunisairauksia potilailla, joilla ei ole aiemmin esiintynyt immuunivälitteisiä tulehdussairauksia. Näiden autoimmuunitautien pitkän ajan vaikutukset ovat vielä tuntemattomia.
Havainnot herättävät kysymyksiä. Selittääkö infektio immuunivälitteisten tulehdussairauksien (IMID) syntymekanismia? Voiko infektio johtaa uusien autoimmuunisairauksien kehittymiseen? Millainen vaikutus koronapotilailla havaituilla autovasta-aineilla on pitkittyneeseen korona-oireyhtymään?
Infektiot voivat laukaista autoimmuniteetin perinnöllisen herkkyyden omaavilla potilailla. COVID-19-infektion levitessä myös havainnot infektion aiheuttamista autovasta-aineista ja pitkittyneistä oireista lisääntyvät.
Esimerkiksi Guillain-Barrén oireyhtymä ja immuunisytopenia (verisolujen niukkuus – erityisesti lymfopenia, eli valkosolujen niukkuus) assosioituvat COVID-19-infektioon.
Lymfopeniaa havaitaan varsinkin vakavissa koronainfektioissa. T-solujen vähentyminen infektiossa, jossa T-solujen pitäisi tuhota viruksia liittyy vahvasti vakavampiin koronainfektioihin. Noin vuosi sitten amerikkalaiset ja kiinalaiset tutkijat havaitsivat, että SARS-CoV-2-virukset voivat infektoida kehon puolustusjärjestelmän T-soluja, mikä selittäisi lymfopenian ja T-solutasojen romahduksen.
Monilla COVID-19-potilailla havaitaan ”merkittäviä auto-vasta-aineita”. Yhdessä tutkimuksessa Bostonin yliopiston lääketieteellisen korkeakoulun tutkijana toiminut MD Nahid Bhadelia ja hänen kollegansa raportoivat havainnoista, jotka tukevat immuunivasteiden indusointia itse-epitooppeihin akuutin vakavan COVID-19:n aikana sekä todisteita yleisestä B-solujen hyperaktiivisuudesta.
Yalen lääketieteellisen korkeakoulun Eric Y. Wang tutkijakollegoineen vahvisti havainnot, jotka osoittavat COVID-19-infektion eksoproteomeihin (solun ulkoisiin proteiinijoukkoihin) kohdistuvien autovasta-aineiden patologisen roolin. Havaitulla mekanismilla on erilaisia vaikutuksia immuunijärjestelmän toimintaan. Vaikutukset assosioituvat potilaan oireista tehtäviin kliinisiin havaintoihin.
Vertaisarviointia odottavassa tutkimuksessa Sarah Esther Chang kollegoineen Stanfordin yliopiston lääketieteellisestä korkeakoulusta havaitsi, että SARS-CoV-2-virus voi laukaista uusien IgG-autovasta-aineiden ilmaantumisen merkittävällä osalla sairaalahoitoa saavista potilaista. Nämä autovasta-aineet korreloivat positiivisesti SARS-CoV-2-proteiinien immuunivasteisiin.
Nature -lehdessä tammikuussa julkaistussa tutkimuksessa Alexis J.Combes, PhD, Kalifornian yliopistosta ja hänen kollegansa selvittivät viruspuolustuksen uudelleenkäynnistämiseen tähtääviä tavoitteita immuuniterapiana potilaille, jotka sairastavat vaikeaa COVID-19-infektiota.
Potilaat, jotka sairastavat COVID-19-infektiota, kehittävät omiin kudoksiin reagoivia autovasta-aineita. Tämä ei ole triviaali ilmiö. Autovasta-aineet vaurioittavat omia kudoksia ja elimiä. Pidempiä ja vakavampia infektioita sairastaneilla on havaittu vaurioita keuhkoissa, aivoissa, sydämessä, maksassa, munuaisissa ja verisuonissa. Vauriot on osoitettu mm. magneettikuvantamisella. Aivovaurioista kertovat pitkittyneet neurologiset, psykologiset ja kognitiiviset oireet, jotka havaitaan esimerkiksi terveitä verrokkeja heikompina kognitiivisina kykyinä. On viitteitä siitä, että vakava koronainfektio voi heikentää älyllisiä kykyjä.
Tutkijat havaitsivat autovasta -aineita noin 50%:lla tutkimuksissa mukana olleista potilaista. Osa havaituista autovasta-aineista hävisi melko pian, mutta jotkin autovasta-aineista pysyivät elimistössä infektion jälkeen.
COVID-19-infektion jälkeisten seurausten pitkän aikavälin vaikutukset ovat yhä tuntemattomia. Morbidity and Mortality Weekly Report -raportissa ja JAMA:ssa julkaistut tiedot osoittavat, että 35% COVID-19-potilaista ei palaa normaaliin terveydentilaansa 2-3 viikon kuluttua infektiosta parannuttuaan. 55%:lla koronainfektion sairastaneista oli kolme tai useampia pysyviä oireita 60 päivää oireiden alkamisen jälkeen.
4 182 potilaasta, jotka määritelivät terveydentilansa ”normaaliksi” ennen COVID-19-tartuntaa, jatkuvista oireista kärsi 13,3% 4 viikkoa, 4,5% 8 viikkoa ja 2,3% 12 viikkoa infektion jälkeen.
Jätän teille tämän ajatuksen: olemme lähempänä alkua kuin loppua. – Leonard H. Calabrese
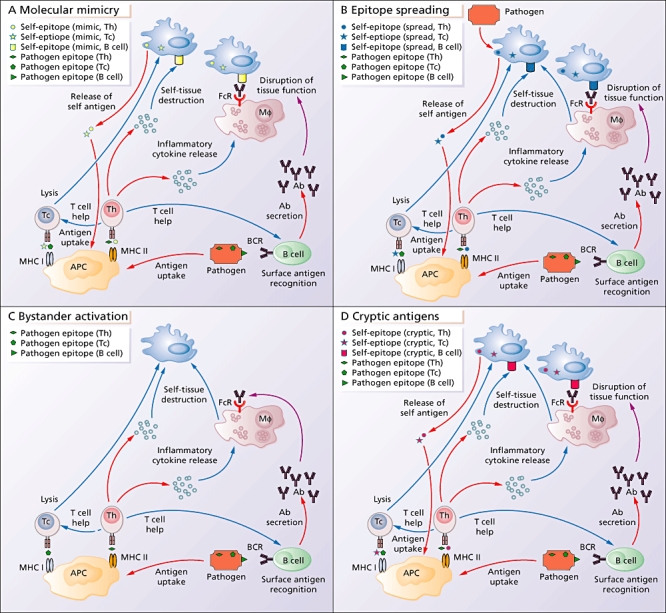
Mekanismeja joilla patogeenit voivat aiheuttaa immuunijärjestelmän herkistymisen omille kudoksille.