Ravinto ja evoluutio: Lucy & fat of the land
Miten meistä tuli ihmisiä ja mikä erottaa ihmiset muista luontokappaleista? Entä mitä ensimmäiset esi-ihmiset ja ihmiset söivät? Näihin kysymyksiin on esitetty monia kiinnostavia vastauksia. Yritän rekonstruoida esihistorian ja Homojen historian kompaktiin ja helposti pureskeltavaan pikaruokapamflettiin.
Viimeisen vuosisadan aikana syömämme ravinto on muuttunut valtavasti, mutta geenien ja aineenvaihdunnan toiminnan osalta emme ole muuttuneet juuri lainkaan kymmeniin tuhansiin vuosiin.
Yritän hahmotella johdonmukaisen selvityksen esihistoriallisten ihmisten ruokavaliota avaavien luentojen pohjalta. Neil Armstrongin sanoja mukaillen: arvoitukset herättävät ihmetystä ja ihmetys johtaa haluun ymmärtää.
Planeetta Helvetti
Alussa oli Helvetti. Satoja miljoonia vuosia myrskyävä kahden miljardin kuutiokilometrin hornankattila ja vulkaanisesti aktiivinen kiehuva planeetta. Neljä miljardia vuotta sitten nuori maailmamme muistutti enemmän helvettiä kuin paratiisia. Nuori maa oli painajaismainen, kaoottinen ja villi kurimus, jonka kaasukehän toiseksi yleisin aine oli hiilidioksidi.
Ensimmäinen solu kehittyi tässä noidankattilassa noin 3,5 miljardia vuotta sitten. Se oli ehkä kemoheterotrofi, joka hyödynsi elinympäristönsä orgaanisia yhdisteitä. Alkusoluille muodostui kyky valmistaa orgaanisia yhdisteitä hiilidioksidista muuttamalla valoenergiaa kemialliseen muotoon. Soluista tuli fotosynteettisiä.
Miljoonia vuosia, muutamaa hetkeä ja yhtä epookkia myöhemmin soluille kehittyi kyky käyttää vettä fotosynteettisenä elektronilähteenä. Näin muodostui kehittyneemmän elämän kannalta kriittinen happea tuottava fotosynteesi. Happea kertyi nuoren planeetan kaasukehään. Jotkin organismit sopeutuivat happeen ja alkoivat käyttää sitä energianlähteenä.
Prokaryootit, eli esitumalliset tumattomat yksisoluiset eliöt eriytyivät jo varhain bakteereihin ja arkeoneihin.
LUCA
Viimeinen tunnettu yhteinen esivanhempamme LUCA (Last Universal Common Ancestor) ei ollut ensimmäinen eliö, mutta se oli viimeisin yhteinen alkusolu, josta kaikki maapallolla nykyisin elävät eliöt ovat polveutuneet. LUCA kehittyi noin 3,5–3,8 miljardia vuotta sitten (paleoarkeeisen maailmankauden aikana).
Aitotumaisia eukaryootteja kehittyi alkuemereen 1,5–2 miljardia vuotta sitten. Niiden syntytapaa ei tunneta. Monisoluiset eliöt kehittyivät vasta 600-800 miljoonaa vuotta sitten. Soluille energiaa tuottava mitokondrio oli varhaisen esieukaryoottisolun kanssa endosymbioosissa elänyt aerobinen bakteeri.
Solu on elämän perusyksikkö
Elämä tarkoittaa yksinkertaisimmillaan soujen aineenvaihduntaa. Solu on kaikkien elävien organismien sähköisesti varautunut perusyksikkö.
Ihmisillä ja muilla suvullisesti lisääntyvillä eläimillä solut voidaan jakaa somaattisiin soluihin ja ituradan sukusoluihin eli gameetteihin. Somaattiset solut syntyvät mitoosissa ja sukusolut meioosissa. Olen käsitellyt syntymän ihmettä tarkemmin täällä.
Ihmisen kudoksesta yli 96 % muodostuu neljästä alkuaineesta. Vedyn, hiilen, typen ja hapen lisäksi kudoksissa on pieniä pitoisuuksia natriumia, magnesiumia, fosforia, rikkiä, klooria, kaliumia ja kalsiumia. Solut ovat 60–90 prosenttisesti vettä. Solujen tärkeimpiä orgaanisia yhdisteitä ovat lipidit, hiilihydraatit, proteiinit sekä nukleiinihapot (DNA ja RNA).
Paratiisin puutarhassa elämä on paikka, jossa elektroni lepää
Kaikki elämä edellyttää ravintoa. Ravintoon ja sitä hyödyntävään lajistoon vaikuttaa ilmasto, joka vaihtelee eri paikoissa. Ilmastolliset tekijät, kuten lämpötila ja sademäärä, aiheuttavat eroja eri alueiden kasvillisuudessa, mikä perusteella maapallo jaetaan ilmasto- ja kasvillisuusvyöhykkeisiin.
Tuulet tuovat kosteutta maalle. Pasaatituulet kohtaavat tropiikissa ja aiheuttavat ukkosilmoja, kosteutta ja monsuuneja. Pasaatituulten pohjois- ja eteläpuolella noin 30. leveysasteen kohdalla on vain vähän tuulia, minkä johdosta valtameriltä ei tule mantereille paljon kosteutta. Paratiisin puutarhan suuret aavikkoalueet sijaitsevat näillä leveysasteilla.
Valtameret tuovat kosteutta, joka synnyttää sademyrskyjä ja tasaa rannikkoseutujen lämpötiloja. Elämää esiintyyy lähes kaikkialla ilmakehästä aina viiden kilometrin syvyyteen asti. Tiedetään, että elämä ja ihmiset ovat sopeutunut hyvin erilaisiin olosuhteisiin, mutta mitä se elämä on?
Erwin Schrödinger määritteli 1940-luvulla elämän negatiiviseksi entropiaksi. Albert Szent-Györgyi kuvasi elämän paikaksi, jossa elektroni voi levätä. Biologiassa elämän ominaisuudeksi mainitaan yleensä kyky tuottaa uusia kopioita itsestään. Astrobiologi André Brackin mukaan elämä on “vesiliukoinen kemiallinen systeemi, joka siirtää molekyylirakenteisiin sisältyvän informaation ja kehittyy”. Addy Pross ja Robert Pascal toteavat, että elämä on toiminnallisuuteen perustuva stabiili tila, joka toimii ulkopuolelta tulevan energian varassa.
Elämä, mitä ikinä sillä tarkoitetaankaan, syntyi noin 3,5-4,0 miljardia vuotta sitten. Alkellista elämää oli aluksi vain merissä. 800 miljoonaa vuotta sitten kehittyivät ensimmäiset alkueläimet, jotka käyttivät ravintonaan muita eliöitä. Toisten eliöiden käyttäminen ravintona on yksi elämän kiertokulkua ylläpitävistä luonnon perusmekanismeista.
Alkueläimet kehittyivät 120 miljoonan vuoden kuluessa monimutkaisiksi ja monisoluisiksi eläimiksi. Selkärangattomien eläinten perusryhmät ilmestyivät proterotsooisen kauden lopulla ja paleotsooisen kauden alussa noin 540 miljoonaa vuotta sitten.
Ensimmäiset maakasvit kehittyivät noin 450 miljoonaa vuotta sitten. Sammakkoeläimiä alkoi nousta maalle devonikaudella. Triaskaudella 245–200 miljoonaa vuotta sitten ilmestyivät nisäkkäät, sisiliskot, dinosaurukset, kilpikonnat ja krokotiilit. Dinosaurusten valtakausi kesti 160 miljoonaa vuotta. Ensimmäiset ädelliset kehittyivät dinosaurusten joukkosukupuuton jälkeen 65 miljoonaa vuotta sitten.
Miten solut saavat energiaa?
Solujen rakenne ja aineenvaihdunta ovat käytännössä hyvin samanlaisia nyt kuin alkumeren ensimmäisillä soluilla:
- vettä 50–90 prosenttia
- hiili, vety, typpi ja happi
- samoja sokereita, aminohappoja, nukleotideja, rasvahappoja, fosfolipidejä, vitamiineja ja entsyymejä
- tärkeimpinä makromolekyyleinä proteiinit, lipidit, hiilihydraatit ja nukleiinihapot
- samanlainen solujen kaksinkertainen solukalvo
- entsyymien välityksellä tapahtuvat solujen reaktiot
- samanlainen prosessi energian tuottamiseksi ja saamiseksi
- välireaktioista koostuvat aineenvaihdunnan reaktiot
- DNA:sta koostuva solujen perimä
- kaikissa soluissa olevat ribosomit, joissa proteiinisynteesi tapahtuu
- perimässä tapahtuvat mutaatiot, jotka voivat muuttaa kaiken elollisen ilmiasua.
Solujen energialähteinä toimivat hiilihydraatit ja rasvahapot. Myös proteiineja voidaan käyttää energianlähteinä, mutta silloin aminohapoista on syntetisoitava glukoosia glukoneogeneesissä.
Aitotumallisissa soluissa rasvahapot hapetetaan mitokondrioissa β-oksidaatiossa, jolloin syntyy pelkistyneitä elektroninsiirtäjäkoentsyymejä NADH:ta ja FADH2:ta. Hiilihydraatit pilkotaan ja muokataan ensin glukoosiksi tai sen johdannaisiksi. Solulimassa tapahtuvassa glykolyysissä glukoosimolekyylit hajotetaan pyruvaatiksi, mikä tuottaa NADH:ta ja ATP:tä.
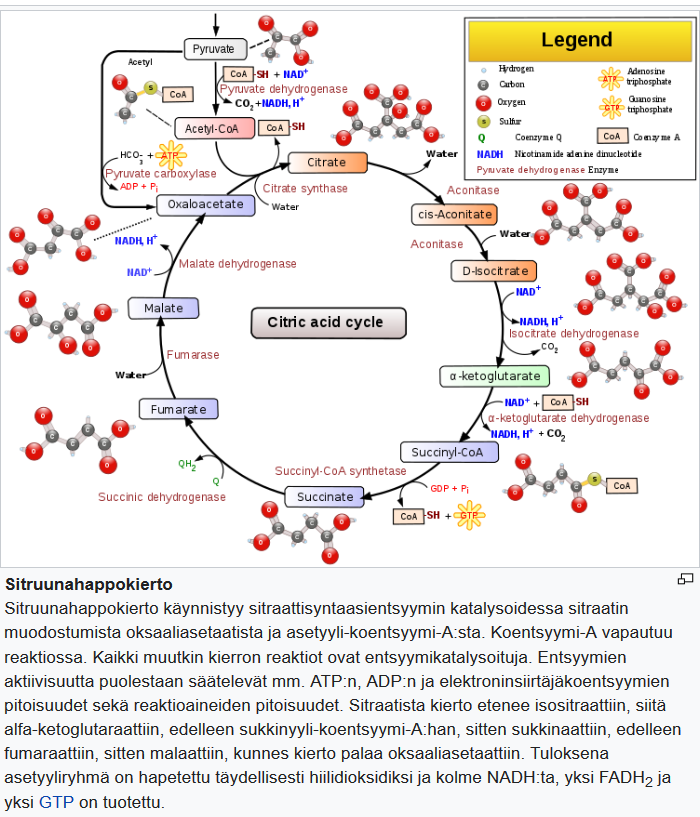
Sekä pyruvaateista että rasvahappojen hapetustuotteista muodostetaan asetyylikoentsyymi-A:ta, joka on kaikkien energiaravinteidren yhteinen välimuoto mitokondrioiden sitruunahappokierrossa. Asetyylikoentsyymi-A pilkotaan hapettamalla sitruunahappokierrossa, mikä tuottaa NADH:ta ja FADH2:ta.
Sitruunahappokierron jäännöstuotteina ovat vesi ja hiilidioksidi. Kun läski palaa, suurin osa osa haihtuu ulos hengitetyn hiilidioksidin ja ihon hikoilun välityksellä.
Aerobisten eli happea käyttävien solujen mitokondrion elektroninsiirtoketjussa aiemmissa reaktioissa tuotetut NADH ja FADH2 luovuttavat elektroninsa eli hapettuvat NAD+:ksi ja FAD:ksi pelkistäen hapen vedeksi ketjureaktion jälkeen.
Seurauksena mitokondrion sisemmän kalvon eri puolille syntyy protonikonsentraatiogradientti, jossa matriisi on emäksisempi kuin solulima. Proteiinikanavat eli ATP-syntaasit antavat protonikonsentraation tasoittua tekemällä samalla protonivirrasta saatavalla energialla ADP:sta ja fosfaatista ATP:ta oksidatiivisessa fosforylaatiossa.
ATP on solun perusenergiamolekyyli, jota entsyymit käyttävät reaktioihinsa.
Solu ottaa aineita ympäristöstään endosytoosilla, joka voidaan jakaa kahteen mekanismiin: fagosytoosiin (”solusyönti”) ja pinosytoosiin (”solun juominen”). Molemmissa tapahtumissa solun ulkopuolella olevat molekyylit kiinnittyvät solukalvon reseptoreihin ja saavat aikaan solukalvon vetäytymisen kuopalle. Kuoppa syvenee, ja lopulta kuoppa irtoaa solun sisälle endosomina ja solukalvo umpeutuu kiinnittymällä vastakkaiseen reunaan. Endosomi yhdistyy solussa lysosomin kanssa.
Lysosomi sisältää entsyymejä, jotka hajottavat endosomin sisällön solun käyttöön. Esimerkkinä fagosytoosista on, kun fagosytoivat solut (makrofagit, neutrofiilit) syövät bakteereja ja tappavat ne sisällään. Fagosytoosin jälkeen ns. myöhäinen endosomi liitetään yleensä uudestaan kalvolle eksosytoosilla, jolloin sen sisältämät kuona-aineet vapautuvat soluvälitilaan. Eksosytoosi on käänteinen endosytoosille. Wikipedia
Solujen syntymä
Solut syntyvät soluista jakautumalla joko mitoottisesti tai meioottisesti. Mitoosissa solu jakautuu kahdeksi identtiseksi kopioksi. Solunjakautuminen kestää noin tunnin, ja sitä seuraa välivaihe, joka on mitoosia paljon pitempi.
Meioosia esiintyy ainoastaan sukusolujen eli munasolujen ja siittiöiden muodostuessa. Meioosissa on kaksi peräkkäistä solunjakautumista, joista syntyy neljä haploidista sukusolua.
Verisolut, monet epiteelisolut ja siittiöt jakautuvat hyvin nopeasti. Suolen epiteelisolut uusiutuvat noin kerran viidessä vuorokaudessa. Maksan solut uusiutuvat keskimäärin kerran kuukaudessa. Hermosolujen kyky jakautua päättyy yleensä hermosolun erikoistumiseen. Suurin osa hermosoluista syntyy jo sikiövaiheessa. Uusia hermosoluja syntyy jonkin verran hippokampuksessa. Jos hermosolujen regeneraatiota tapahtuu, se on ilmeisen hidasta.

Ihmisen elämä on lyhyt kuin päivänkorennon lento
Evoluution ajallista perspektiiviä on vaikea hahmottaa. Elinaikamme on lyhyt kuin päivänkorennon lento. Näemme tuokion maailmasta. Henkilökohtainen elämämme on tuskin muuta kuin silmänräpäys ihmisen kehityshistoriaan.
Evoluutiossa havaittaviin muutoksiin ja lajiutumiseen vierähtää tuhansia sukupolvia. Ympäristössä ja ravinnossa tapahtuneet muutokset voivat vaikuttaa epigeneettisesti lajien sopeutumiseen ja kehitykseen hyvin lyhyessä ajassa.
Lajina päivänkorennot ovat meitä ihmisiä vanhempia. Vanhimmat päivänkorentojen fossiilit on ajoitettu permikauteen kahden- tai kolmensadan miljoonan vuoden päähän menneisyyteen. Permikausi oli matelijoiden, kuten synapsidien, pelykosaurien ja nisäkkäitä muistuttavien terapsidien aikaa. Päivänkorennot olivat olemassa ennen dinosauruksia ja ovat olemassa luultavasti kauan sen jälkeen, kun nykyihmisen jättämät jäljet ovat peittyneet ajan tomuun.
Varhaisia terapsoideja kutsuttiin nisäkäsmäisiksi matelijoiksi. Terapsidit korvasivat muut synapsidit permikauden aikana noin 269 miljoonaa vuotta sitten. Terapsidien valtakausi kesti keskiselle triaskaudelle asti. Sen jälkeen (noin 245–216 milj. v. sitten) alkoi Archosauromorpha-matelijoiden kuten krokotiilien varhaisten sukulaisten ja dinosaurusten vuoro hallita maailmaa suurimpina maaeläiminä. Terapsidit nousivat nisäkkäinä uudelleen hallitsevaan asemaan kenotsooisella maailmankaudella noin 65 milj. v. sitten.
Elämän uusi aika, eli kenotsooinen maailmankausi
Ihmisten kantamuodot alkoivat kehittyä noin 65 miljoonaa vuotta sitten mesotsooisen maailmankauden lopulla kissaa pienemmistä pitkäkuonoisista kädellisistä.
Kenotsooisen kauden kahdeksan epookkia on nimetty eläimistön monimuotoisuuden mukaan kreikaksi. Ihmisen kehittymiseen johtanut ajanjakso alkoi hieman ennen pleistoseenikauden alkua.
- Paleoseeni paleos, muinainen (66-56 miljoonaa vuotta sittten)
- Eoseeni eos, sarastus (56-33,9 miljoonaa vuotta sitten)
- Oligoseeni oligos, muutama (33,8-23,8 miljoonaa vuotta sitten)
- Mioseeni meion, vähemmän (23-5,33 miljoonaa vuotta sitten)
- Plioseeni pleion, enemmän (5,3-2,6 miljoonaa vuotta sitten)
- Pleistoseeni pleistos, eniten (2,588 miljoonaa -11 560 vuotta sitten)
- Holoseeni, holos, kokonaan, kaikki (alkoi 11 560 vuotta sitten, eli 9600 eaa.)
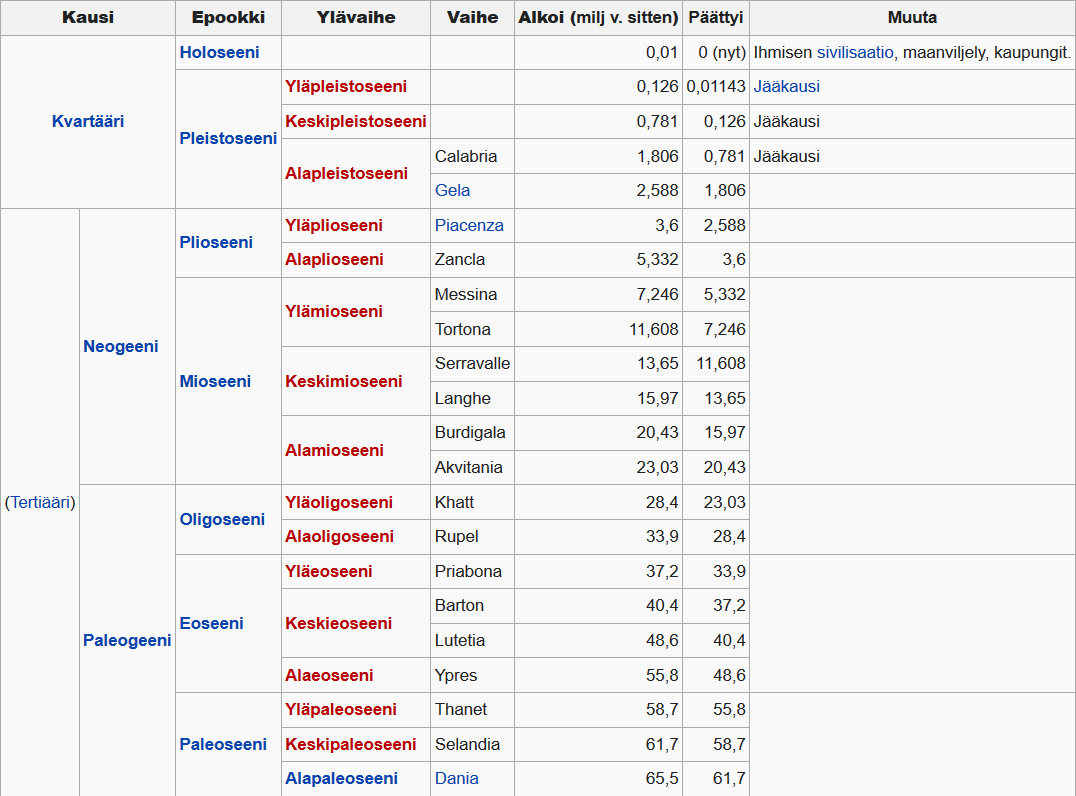
Kenotsooinen maailmankausi on geologinen ajanjakso, joka alkoi liitukauden lopun joukkosukupuutosta noin 65 miljoonaa vuotta sitten ja jatkuu edelleen.
Kauden alussa ilmasto oli hyvin lämmin ja kostea, mutta alkoi kauden edetessä viiletä ja kuivua. Metsää kuivemmat ruohoa kasvaneet savannit ja arot valtasivat maa-alaa. Tämä mahdollisti monien suurten maanisäkkäiden, kuten hevosten ja norsueläinten kehityksen. Kauden aikana kädelliset kehittyivät ihmisapinoiksi ja edelleen ihmisiksi.
Paleoseenikauden alkukädelliset olivat kissaa pienempiä ja pitkäkuonoisia. Eoseenikauden nykyisiä makeja ja kummituseläimiä muistuttavien kädellisten etuna oli ruumiinpainoon nähden suuret aivot ja kyky hyödyntää monipuolisesti erilaisia ravinnonlähteitä.
DNA-mallien perusteella itä- ja länsiapinat erkanivat varhain eoseenikauden lopulla. Häntä- ja ihmisapinat erkanivat oligoseenikauden lopulla. Ihmiset ja ihmisapinat, kuten simpanssi, erkanivat omiksi kehityslinjoikseen noin seitsemän miljoonaa vuotta sitten.
Suuri joukkosukupuutto pyyhki Maata eoseeni-kauden lopulla. Samoihin aikoihin tapahtui myös merivirtojen muutoksia. Ilmasto viileni ja heinäkasvit yleistyivät. Valtavat ruohotasangot levittäytyivät Maan pinnalle.
Oligoseenikaudella ruohoaroille ilmestyi erilaisia laiduntajia sekä niitä saalistavia kissa- ja koiraeläimiä. Sapelihampaat kehittyivät moneen kertaan eri eläinlajeille. Norsueläimistä kasvoi hyvin suuria.
Kauden lopulla kädellisten kehitys johti ihmisapinoiden, apinaihmisten ja ihmisen syntyyn. Plioseenilla Afrikassa eli eteläapinoita, joista kehittyi jo ennen pleistoseenia nykyihmisen edeltäjiä.
Kasviravintoa syövä Ramapithecus oli enemmän apina kuin apinaihminen. Hieman myöhemmin (2-3 miljoonaa vuotta sitten) elänyt Australopithecus africanus oli ruumiinrakenteensa ja hampaidensa perusteella sekasyöjä.
Eräs mielenkiintoinen huomio on se, että eräillä villikoirilla esiintyvät laakamadot yleistyivät näihin aikoihin ihmisapinoilla.

Ilmasto muuttuu ja muutos vaikuttaa lajien migraatioon ja kehitykseen
Ilmaston muuttuminen on ohjannut kaikkien lajien sopeutumista ja kehittymistä. Kenotsooisella kaudella Afrikan ja Euroopan välissä kulki lämmin merivirta. Meri oli selvästi korkeammalla ja peitti suuremman osan maapallosta.
Esimerkiksi Saharassa ilmaston vaihtelu kosteasta kuivaan on ollut syklistä miljoonien vuosien ajan. Viimeisimmän jääkauden jälkeen Saharan alue oli vehreää savannia, jossa asui kirjava eläinkanta ja ihmisyhteiskuntia. Ihmisten pääasiallinen elinkeino alueella oli maanviljely ja metsästäminen. Monsuunisateet olivat alueella yleisiä, mutta ne alkoivat vähentyä noin 8000 vuotta sitten. Saharan alueen ilmastonmuutos johtui muutoksista maapallon kiertoradassa ja kallistuskulmassa. Vielä 10 000 vuotta sitten Saharan alue oli täynnä jokia ja järviä.
Paleoseenikauden lopussa kenotsooisen kauden ilmasto lämpeni yhä. Noin 55,5 miljoonaa vuotta sitten lämpötila nousi ~10 000 vuoden aikana keskileveyksillä 4–8 °C. Tämän lämpöhuipun (PETM) aiheutti todennäköisesti tulivuorenpurkausten ja syvänmeren metaanikatraattimineraaleihin sitoutuneen metaanin vapautumisen aiheuttama kasvihuoneilmiö. Kuuman lämpöhuipun jälkeen maailma koki vielä pitkän ja lämpimän eoseenin lämpöoptimin, minkä jälkeen maapallo alkoi jäähtyä.
Mioseeni oli Euroopassa lämmin ja kostea, mutta trooppiset lajit alkoivat kauden edetessä kadota. Palmut hävisivät Alppien pohjoispuolisesta Euroopasta. 7–5 miljoonaa vuotta sitten Afrikka viileni ja aavikoitui.
Maapallon lämpötila romahti ~2,74 miljoonaa vuotta sitten kylmään jääkausitilaan, jossa jääkauden ja lämpökaudet vuorottelivat. Pleistoseenikaudella oli arviolta 26 jäätiköitymistä, joista kymmenen olivat suuria. Pitkät jääkaudet alkoivat viimeistään 0,9 miljoonaa vuotta sitten.

Sään armoilla
Ihmisten kehityslinjan eritymiseen vaikutti miljoonien vuosien aikana muuttunut ilmasto ja ympäristö. Selviytyminen edellytti sopeutumista ja sopeutuminen johti kehitysaskeliin, kuten kahdella jalalla liikkumiseen, aivojen kasvuun, tulen keksimiseen ja kieleen perustuvaan kommunikaatioon.
Ensimmäinen merkittävä kehitysaskel tapahtui 7–8 miljoonaa vuotta sitten, kun ilmasto muuttui kuivemmaksi ja viileämmäksi. Metsät vähenivät ja savannit laajenivat. Muutoksen seurauksena ihmisen kantamuodon oli laskeuduttava puista ja sopeuduttava elämään savanneilla. Näihin aikoihin ihmisen kantamuodot erkanivat ihmisapinoiden kantamuodoista.
Jotkut apinalajit sopeutuivat elämään savanneilla nousemalla kahdelle jalalle. Tällaisesta oli selviä etuja. Pystyasennossa liikkuminen vapautti kädet, pitkät etäisyydet taittuivat tehokkaammin kahdella jalalla ja pystyasento paransi lämmönsäätelyä kuumilla ja kuivilla ruohotasangoilla. Kahdelle jalalle nousemisen uskotaan johtaneen työkalujen tehokkaampaan käyttöön.
Savannilla kahdella jalalla kulkevat apinat näkivät kauemmaksi. Seksuaalista valintaa ei myöskään voi sivuuttaa. Naaraat suosivat kookkaita ja vahvoja uroksia kaikissa apina- ja ihmispopulaatioissa.
Seuraava merkittävä kehitysaskel oli työkalujen käyttö. Savanneilla elävät ihmisapinat oppivat hajottamaan luita hakkaamalla niitä kivillä.
Tämä vaihe ihmisen evoluutiossa sivuutetaan usein hyppäämällä puista suoraan työkaluja taidokkaasti hyödyntäviin metsästäjäkeräilijöihin. Apinaihmiset eivät aloittaneet suurriistan metsästämistä heti savanneille sopeuduttuaan, vaikka saattoivat pyydystää ravinnoksi pienriistaa samaan tapaan kuin simpanssit.
Toban vaikutus?
73 800 votta sitten Sumatralla purkautui jättitulivuori Toba. Yhdellä kertaa taivaalle räjähti 8000 kuutiokilometriä vulkaanista tuhkaa ja kiveä. Toban kraateri on 100 km pitkä ja 35 km leveä.
Rikkikaasut levisivät ilmakehään ja heijastivat suuren osan auringon lämpösäteilystä avaruuteen 5-6 vuoden ajan. Lähes valkoinen tuhka levisi ainakin 21 miljoonan neliökilometrin alalle, mutta todennäköisesti ohut tuhkakerros levisi paljon laajemmalle. Vaaleaa tuhkaa on löydetty 10 cm tasainen kerros esimerkiksi yli 400 neliökilometrin alueella tehdyissä kaivauksissa Intiassa. Vaalean tuhkan albedovaikutus heijasti lämpösäteilyä maan pinnalta samaan tapaan kuin jäätiköt.
Hiili-isotooppianalyysin perusteella tuhkakerroksen alapuolinen maa-aines on peräisin metsistä (C3), kun tuhkan päällä oleva maakerros on peräisin ruohokasveista (C4). Tämä tiedetään, koska maatuneiden metsien hiili-isotoopit eroavat maatuneiden ruohokasvien hiili-isotoopeista.
Alueilla, johon Toban purkaus vaikutti oli aiemmin metsiä ja purkauksen jälkeen ruohoa kasvavia aroja. Toba aiheutti vuosia kestäneen ydintalven.
Apinoiden, apinaihmisten ja ensimmäisten ihmisten kehitystä on tarkasteltava muuttuvan ilmaston, ympäristön ja lajiston viitekehyksessä. Lämpötilan muutokset ja Toban kaltaiset luonnonmullistukset vaikuttivat ravinnon laatuun, saatavuuteen ja migraatioon.
Muutokset pakottavat lajit sopeutumaan uudenlaiseen ilmastoon ja uusiin ravinnonlähteisiin. Evoluutiolla on monia mekanismeja, mutta muuttuva ilmasto johtaa adaptaatioihin ja luonnonvalintaan, joka karsii heikommin ympäristöön sopeutuvat geenit geenipoolista.
Ihmisen evoluutio
Perinteinen evoluutiopuu on geneettisen tiedon lisäännyttyä muuttunut sotkuisemmaksi. Adam Rutherford kuvaa nykyihmisen kehitykseen johtavaa puolen miljoonan vuoden epookkia termillä ”clusterfuck”.
Käytännössä hän tarkoittaa, että pitkään vallalla ollut kuva ihmisen kehityshistoriasta erilaisten kehitysharppausten kautta etelänapinoista valkoiseksi mieheksi kuvaa huonosti todellisuutta. Geneettisen datan perusteella ajallisesti päällekkäin lomittuvia ihmislajeja oli ainakin kahdeksan ja ne sekoittuivat keskenään useita kertoja eri aikoina (clusterfuck).
Rutherfordin mukaan massiiviset muuttoliikkeet Afrikasta Aasiaan ja Eurooppaan tapahtuivat hyvin hitaasti kymmenien tuhansien vuosien aikana. Pienet populaatiot vaelsivat luultavasti ravinnon perässä ja lisääntyivät kohtaamiensa muiden ihmispopulaatioiden kanssa.
Länsi- ja itä-Neandertalin ihmisten geenit sekoittuivat Homo sapiensin geeneihin useita kertoja Euroopassa ja Euraasiassa. Aasiassa Denisovan ihmisten geenejä sekoittui Aasiaan vaeltaneisiin populaatioihin. Ja toisiin ihmislajeihin sekoittuneet lajit sekoittuivat myös keskenään. Se oli kaikin tavoin hyvin sekavaa.

Ihmisapinasta apinan tavoin käyttäytyvään ihmiseen
Sahelinapinaihminen eli Tšadissa 6-8 miljoonaa vuotta sitten. Sen kallo muistutti joiltain osin simpanssia ja joiltain osin ihmistä. Sahelinapinaihminen eli aikana, jolloin ihmisen ja simpanssin kehityslinjat alkoivat erkaantua. Se saattoi olla molempien kantamuoto tai kuulua jompaankumpaan kehityslinjaan. Luultavasti Sahelinapinaihminen käytti samanlaista ravintoa kuin ihmisapinat.
Tugeeniapinaihminen eli mioseenikaudella 5,7-6,2 miljoonaa vuotta sitten. Tugeeniapinaihminen voi olla ihmisen suora edeltäjä, mutta voi olla olemattakin. Todennäköisesti samaan aikaan eli muitakin apinaihmislajeja, jotka saattoivat olla rinnakkaisia kehityslinjoja tai ihmisen suoria esivanhempia.
Australopithecus
Varhaisin tunnettu etelänapina (Australopithecus) eli 4,1-5,1 miljoonaa vuotta sitten. Sukuun kuului 5-6 lajia. Tunnetuin Australopithecus-fossiili on Beatlesin ”Lucy in the sky with diamonds” -kappaleen mukaan Lucyksi nimetty 3,2 miljoonaa vuotta sitten elänyt Australopithecus afarensis.
Tutkijat päättelivät Lucyn luista, että se oli kuollut putoamalla puusta noin 12 metrin korkeudesta. Se ei ollut yhtä taitava kiipeilijä kuin apinat. Lucyn aivojen tilavuus oli noin kolmanneksen nykyihmisen aivojen tilavuudesta.

Dart ja tappaja-apinat
Raymond Dartin 1924 löytämä Australopithecus africanus oli lihansyöjä, mikä johti tappaja-apina hypoteesiin. Ihmisen luontainen väkivaltaisuus sai Raymond Dartin vakuuttumaan siitä, että ihmisellä oli saalistamiseen pystyvät esivanhemmat.
Robert Ardrey kirjoitti: ”Not in innocence and not in Asia was mankind born”. Stanley Kubrick kuljetti ihmisen evoluution tappaja-apinasta avaruuteen muutamalla vaikuttavalla kuvalla elokuvassa 2001 Avaruusseikkailu.
Varhaisilla savanneilla oli suurten saaliseläinten osin syötyjä raatoja. Ne tarjosivat etelänapinoille luiden sisältämää herkkua. On perusteltua olettaa, että Australopithecus käytti kiviä löytämiensä luiden hajottamiseen. Luissa on runsaasti energiaa sisältävää luuydintä, joka säilyy luissa pilaantumatta hyvin pitkään.
Kenyanthropys platyops
Joidenkin tutkijoiden mukaan Australopithecukset ovat ihmisen esivanhempia, mutta ne saattoivat myös olla rinnakkaismuoto varhaisten ihmisten edeltäjälle Kenyantropukselle.
Australopithecus oli selvästi ihmisen ja apinan välimuoto. Australopithecukset kävelivät pystyssä ihmismäisillä jaloillaan, mutta sillä oli apinan käsivarret ja suuret apinamaiset poskihampaat.
Kenianesi-ihminen (Kenyanthropus platyops, eli litteänaamainen kenianihminen) eli ~3,5 miljoonaa vuotta sitten. Kenianesilla oli ihmismäisiä piirteitä, kuten litteät kasvot. Joidenkin tutkijoiden mukan Kenianesi on ihmisen edeltäjä, mutta jos näin on, Australopithecuksen täytyy olla rinnakkainen kehityslinja. Kenianihmistä seurasi Turkananihminen (Homo rudolfensis) 1,9 miljoonaa vuotta sitten.
Ihmisten suvun (Homo) eriytyminen apinaihmisten ja ihmisten yhteisestä kantamuodosta ajoitetaan tavallisesti 2,0-2,5 miljoonan vuoden taakse. Ensimmäisenä varsinaisena Homo-suvun edustajana pidetään yleensä yksinkertaisia kivityökaluja käyttänyttä Homo habilista, eli käteväihmistä, jonka aivojen tilavuus oli noin puolet nykyihmisen aivojen tilavuudesta.
Homo habilis
1,9-1,5 miljoonaa vuotta sitten elänyt Homo habilis ei ehkä ollut mikään ruudinkeksijä, mutta ei enää ihan täysi apinakaan.
Australopithecusten, Homo habiliksen ja Homo erectuksen kallon lihaksia ja hampaita vertailemalla havaitaan, että samaan aikaan eli kasviravintoa ja sekaravintoa syöviä Australopithecuksia. Kasviravintoa syövillä ihmisapinoilla on selvästi isommat juurien ja puunverrsojen jauhamiseen soveltuvat poskihampaat.
Hampaat jauhavat, aivot ajattelevat
Elektronimikroskoopeilla voidaan kuvata tarkasti fossiilien hampaiden pintoja, joihin eri ravintoaineet jättävät erilaisia mikroskooppisen pieniä jälkiä. Löydettyjen kallojen mekaniikkaa voidaan mallintaa tietokoneilla, jolloin saadaan tietoa mm. purentalihaksista. Näiden avulla tieto apinaihmisten ja varhaisten ihmisten syömästä ravinnosta on jatkuvasti tarkentunut.
Itä-Afrikasta löytyneiden kallojen (hampaiden ja kallonlihasten) perusteella Australopithecus boisei (Zinjanthropus boisei tai Paranthropus boisei) söi ensisijassa kasviravintoa. Mary Leakeyn 1959 Tansaniasta löytämä vankka-apinaihminen tunnetaan nimellä ”Nutcracker Man” vahvojen leukojen ja poskihampaiden vuoksi. 2,6-1,2 miljoonaa vuotta sitten eläneen lajin arvellaan olevan ensimmäinen kivityökaluja käyttänyt apinaihminen. Vankka-apinaihmisen kallon tilavuus oli 500-550 kuutiosenttimetriä, mikä on isompi kuin simpansseilla, Australopithecus afarensiksella ja Australopithecus africanusilla. Kallossa on yhtäläisyyksiä gorillan kalloon ja se on selvästi kehittynyt tehokkaaseen pureskeluun. Lajin takahampaat ovat noin neljä kertaa nykyihmisen hampaita kookkaammat ja ne sopivat hyvin juurien, pähkinöiden, lehtien ja erilaisten kasvinversojen jauhamiseen.
Selvästi isompikalloisten Homo habiliksen ja Homo erectuksen hampaat ja kallojen lihakset eivät sen sijaan sovellu samanlaisen kasviravinnon syömiseen. Homo habilis ja Homo erectus puolestaan erottuvat kallojen koon, pienempien hampaiden ja – kallon lihasten puolesta työkaluja valmistavina ja ajattelevina sekasyöjinä.
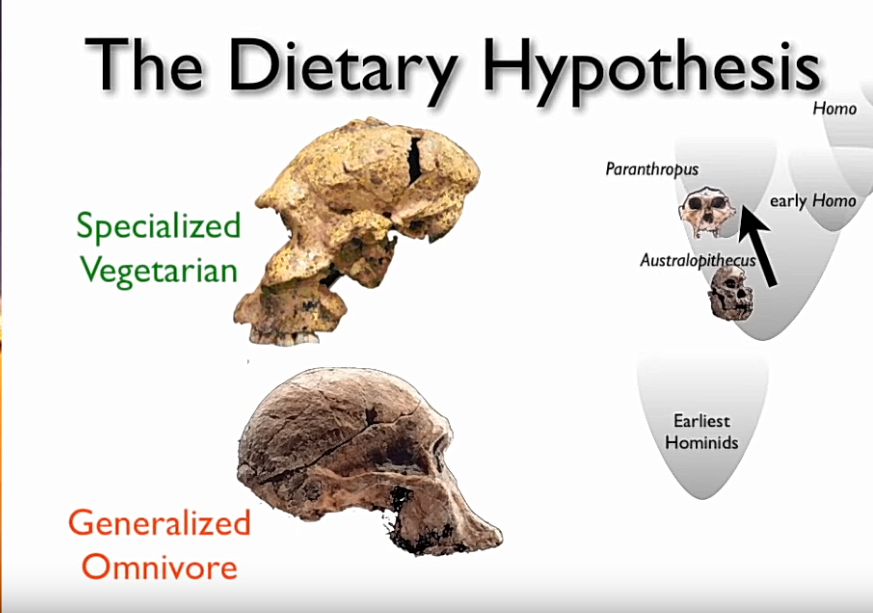
Alkeellisten apinaihmisten ja ihmisten ruokavalio
Savanneilla oli alkuihmisille jotain hyvin arvokasta ja helposti saatavaa: suurten eläinten raatoja, joiden luista varhaiset apinaihmiset saivat rasvaista, ravitsevaa ja herkullista luuydintä. Luuydin sisältää noin kaksi kertaa enemmän energiaa kuin liha tai hedelmät. Se myös säilyy luissa pilaantumatta pitkiä aikoja. Varhaiset apinaihmiset käyttivät ravinnoksi luuydintä rikkomalla luita kivillä.
Apinaihmisten ruumiinrakenne kehittyi yhä ihmismäisemmäksi.Afrikan pystyihminen (Homo ergaster / Homo erectus) levittäytyi Afrikasta Aasiaan ja Eurooppaan.
Tulen ja parempien kivityökalujen käyttöönotto tapahtui 1,5-1,8 miljoonaa vuotta sitten. Homo erectus käytti tulta jo ~1,5 miljoonaa vuotta sitten itä-Afrikassa. Tulenkäyttö oli yleistä kaikilla ihmispopulaatioilla viimeistään 125 000 vuotta sitten. Tulen käyttö yleistyi eri aikoina eri puolilla maailmaa.
Ihmisapinat ja ihmiset ovat aina syöneet raakaravintoa, mutta uskomus raakaravinnon merkityksestä varhaisten ihmisten pääasiallisena ravinnonlähteenä ei perustu arkeologiseen näyttöön tai ihmisen metabolian ja ruoansulatuselimistön toimintaan.
Ihmiset eivät ole koskaan olleet raaka-ravinnolla eläviä fruitaristeja yhtään sen enempää kuin manteleita, banaaneja, kahvia, suklaata, tonnikalaa ja sisäfilettä sisältävällä paleoruokavaliolla. Ravinteiden osalta molemmat ovat hyviä ruokavalioita, mutta hyvin kaukana siitä, mitä ihmisen esivanhemmat söivät.
Ravinnon kypsentäminen tulella alkoi yli miljoona vuotta ennen nykyihmisten kehittymistä. Ruoan kypsentäminen vaikutti ihmisen ruoansulatuskanavan rakenteeseen.
Ihmisen ruoansulatuskanava, maha ja suolisto eroavat hedelmiä ja kasviksia syövien sukulaistemme simpanssien, orankien ja gorillojen ruoansulatuselimistöstä. Ruoansulatuselimistömme ei myöskään muistuta lihansyöjien ruoansulatuselimistöä. Useimmat kasvissyöjät käyttävät suuren osan hereilläoloajasta syömiseen. Ihmisen aineenvaihdunta on kehittynyt niin, että ihminen selviää ilman ravintoa viikkoja. Pätkäpaasto ja ketogeeninen ruokavalio muistuttavat hieman alkuihmisten tapaa syödä, mutta jalostettujen ruokien maailmassa todellisen paleoruokavalion noudattaminen on mahdotonta.
Ihminen ei pysty hyödyntämään ruohoa ravintona niin kuin laiduntavat eläimet. Jos ihmisen ravinto ei sisällä muuta kuin vähärasvaista lihaa, ihminen kuolee nälkään. Ihminen pystyy syömään ruohonsyöjiä ja muita eläimiä sekä monipuolisesti erilaisia kasveja.
Tulen keksimisen seurauksena varhaiset esivanhempamme oppivat kypsentämään juuria ja muita vaikeasti sulavia kasveja. Näin ravinto esikäsiteltiin ruoansulatuselimistöä varten. Kypsytetystä ravinnosta elimistö sai irti enemmän energiaa ja ravinteita.
Neljäs ja ehkä tärkein kehitysaskel oli aivojen kasvu. Aivojen paino on vain muutaman prosentin kehon painosta, mutta aivot käyttävät viidenneksen elimistön tarvitsemasta energiasta. Aivojen kehitys ei olisi ollut mahdollista ilman runsasenergistä ravintoa. Tämän perusteella rasvainen liha ja kypsytetyt tärkkelystä sisältävät mukulajuuret ja muut hiilihydraattien lähteet näyttelivät tärkeää roolia ihmisen kehityksessä.

Aivot tarvitsevat paljon energiaa. Simpanssin aivojen tilavuus on 350-400 kuutiosenttimetriä. Simpanssin aivojen lepokulutus on 10 % energian kokonaiskulutuksesta. Ihmisen aivojen koko on 1350-1400 kuutiosenttimetriä. Ihmisen aivot kuluttavat levossa 20 % ihmisen päivittäisestä energiasta. Se on paljon kun aivojen paino suhteutetaan kokonaispainoon. Aivojen osuus ihmisen painosta on vain pari prosenttia.
Lihansyönti ei yksin selitä aivojen kasvua. Entä hiilihydraatit ja rasvat? Hyviä hiilihydraattien lähteitä, kuten hedelmiä, marjoja, siemeniä ja pähkinöitä on saatavilla vain osan vuotta. Hedelmät ovat varmasti olleet osa ihmisen ravintoa koko evoluutiohistorian. Rasvaa saatiin luuytimistä, pähkinöistä ja rasvaisesta lihasta.
Australopithecusten poskihampaat soveltuivat juurten, kovien siementen ja pähkinöiden syömiseen. Mukulajuuret sisältävät hiilihydraattien lisäksi runsaasti imeytymättömiä kuituja.
Mukulajuurten hyödyntäminen ravintona on yleistä, mutta raakojen mukulajuurien käyttö energianlähteenä on lähes yhtä tehotonta kuin elimistön ruokkiminen männyn juuria jauhamalla.
Nyt siis puhutaan sellaisista juurista, joita apinaihmiset ja varhaiset metsästäjä-keräilijät söivät. Jalostetut runsaasti tärkkelystä sisältävät perunat ja mehevät porkkanat muistuttavat hyvin vähän luonnollisia juurikasveja.
Paleoideologian kompastuskivi on se, että kaikki kasvikset, joita me nykyään syömme, on pitkälle jalostettuja. Paleoruokavalion uskottavuutta lisäisi, jos siinä suosittaisiin vain paikallisia luonnosta kerättyjä marjoja, juuria, lehtikasveja, sieniä jne. runsaasti jalostettujen vihannesten ja hedelmien sijaan. Kivikautiset ihmiset söivät eläimistä kaiken (silmät, aivot, posket, kielen, sisäelimet, rasvan ja luuytimen jne.) eivät vain rasvattomia sisäfilepihvejä.
Varhaisten metsästäjä-keräilijöiden ravinto oli vahvasti sidottu vuodenkiertoon. Talvisin riista saattoi olla ainoa ravinnonlähde, mutta kesäisin syötiin hyvin monipuolisesti erilaisia kasveja. Metsästäjä-keräilijät söivät myös hunajaa.
Mukulajuuria syötiin varmasti ainakin nopeasti kypsennettyinä tai kypsentämättä, kuten hadzat vieläkin tekevät. Nopeakin kypsentäminen lisää mukulajuurten maukkatta. Pidempi kypsennys tekee juuriin sidotun tärkkelyksen paremmin imeytyväksi.
Varhaiset esivanhempamme saivat aivojen kasvun edellyttämän energian kypsennetyistä juurista (ja kausittaisista hiilihydraateista, kuten hedelmistä), hunajasta, lihasta, sisäelimistä ja eläinrasvasta. On hyvin luultavaa, että eläinperäiset rasvat olivat aivojen kehitykselle kriittisen tärkeitä, kuten Jessica Thompson kertoo. Samaan päätelmään päätyy rintamaidon koostumuksen perusteella.
Rintamaito on kasvavan ihmisen parasta ravintoa. Maidossa on noin 7,3 prosenttia laktoosia, 3,4 % rasvaa ja prosentin verran proteiinia. Äidinmaidon rasvahappokoostumus vaihtelee yksilöllisesti, mutta näillä eroilla ei ole havaittu olevan vaikutusta lapsen kasvuun.
Suurin osa rintamaidon rasvoista on tyydyttyneitä, mutta siinä on myös monityydyttämättömiä ja kertatyydyttämättömiä rasvoja, omega-3 ja omega-6-rasvoja, DHA:ta ja EPAa sekä ~10-14 mg kolesterolia / 100 g. Yli puolet rintamaidon energiasisällöstä tulee maidon sisältämistä rasvoista. Rintamaidon proteiineista noin 36 % on kaseiineja, toiset 36 % alfa-laktalbumiinia, noin 9 % immunoglobuliineja ja noin 18 % laktoferriiniä. Äidinmaito sisältää lisäksi entsyymejä, hormoneja ja kasvutekijöitä.
Hadzat
Hadzat ovat nykyihmisen synnyinseuduilla Tansaniassa elävä pieni alkuperäiskansa, joka saa ravintonsa metsästyksestä ja keräilystä, kuten varhaiset esivanhempamme ennen maanviljelyn kehittymistä. Hadzat eivät juurikaan varastoi ruokaa.
Miehet heräävät aamuisin ja lähtevät metsästämään. Naiset keräävät juuria, hedelmiä ja marjoja. Joskus ruokaa löydetään enemmän ja joskus vähemmän. Keskimäärin hadza-naiset keräävät enemmän ravintoa pöytään kuin miehet saavat pyydettyä. Ihmisen aineenvaihdunta on hyvin sopeutunut siihen, että elimistö ei saa jatkuvasti ravintoa. Se on oikeastaan pätkäpaastoilun perusta.
Jos miehet onnistuvat pyytämään suuren riistaeläimen kuten seepran, hadzat syövät usein koko eläimen kerralla. He voivat syödä lihaa ja eläinrasvaa jopa 15 000 kilokaloria päivässä silloin kun sellaisia on saatavilla. Aina niitä ei ole saatavilla. Vuodenajat vaikuttavat luonnon antimiin ja hadzojen syömään ravintoon. Tällä on vaikutuksia mikrobiomiin.
Hadzat eivät syö juuri mitään viljeltyä tai kasvatettua. He eivät kasvata eläimiä ravinnoksi. Käytännössä lähes kaikki hadzojen syömä ravinto löytyy luonnosta.
Hadzojen ruoka on tyyppiesimerkki oikeasta paleoruokavaliosta, tai siitä, mitä paleoideologiassa tavoitellaan. Se ei sisällä prosessoituja hiilihydraatteja, vliljoja. runsaasti tärkkelystä sisältäviä tai teollisesti valmistettuja ruokia.
Teollistuneessa maailmassa paleo-, keto- ja pätkäpaasto-dieetit muistuttavat hieman hadzojen ruokavaliota. Hadzojen elintapoja ei tietenkään voi toisintaa teollistuneissa maissa, mutta ravinto, joka sisältää runsaasti kasviksia, tyydyttyneitä eläinrasvoja ja maltillisesti eläinproteiineja toimii aineenvaihdunnan ja mikrobiomin kannalta paremmin kuin runsaasti tärkkelystä, viljoja ja teollisia rasvoja sisältävä arkiruokavalio.
Hadzat ovat mielenkiintoinen kansa, sillä heillä ei tiettävästi esiinny aineenvaihduntaan liittyviä sairauksia, autoimmuunitauteja tai sydäntauteja, eli sairauksia, jotka liittyvät vahvasti länsimaiseen elämäntapaan.
Ulostenäytteiden perusteella hadzojen mikrobiomi on lajikirjoltaan runsaampi ja elinvoimaisempi kuin meillä, jotka saamme ravintomme tehoviljelystä, teollisista lihavalmisteista ja tehtaissa valmistetuista rasvoista.
Hadzojen mikrobiomi muistuttaa muiden alkuperäiskansojen mikrobiomia, vaikka kansojen viimeinen yhteinen esi-isä on saattanut elää kymmeniä tuhansia uosia sitten. Jos hadzojen mikrobiomi rinnastetaan meidän mikrobiomiimme, se muistuttaa elämää sykkivää viidakkoa, kun meidän mikrobiomimme muistuttaa avohakkuiden raiskaamaa metsää. Ruokavalioltaan ja mikrobiomiltaan hadzat muistuttavat Stanfordin tutkijoiden mukaan maanviljelyn kehittymistä ennen eläneitä metsästäjäkeräilijöitä. He ovat ikkuna siihen, kuinka varhaiset esivanhempamme elivät.
Hadzojen runsaasti kuituja (100-150 g / vrk) sisältävä ruokavalio ravitsee suoliston satoja mikrobilajeja ja biljoonia mikrobeja, joiden aineenvaihdunta tuottaa suolistosta verenkiertoon imeytyviä kemikaaleja, kuten lyhytketjuisia rasvahappoja, joiden tiedetään vaikuttavan kaikkeen immuunijärjestelmän toiminnasta mielialaan. Itse asiassa 97 % ihmisen mukanaan kantamasta geneettisestä materiaalista ei ole omaamme. Elämme täysin mutualistisessa suhteessa suoliston mikrobipopulaation kanssa. Kun ihmisen genomissa on parikymmentä kuitujen aineevaihduntaan vaikuttavaa geeniä, mikrobiomissa on satoja kuitujen pilkkomista ohjaavia geenejä.
https://www.youtube.com/watch?v=tcBtNbFFjMA
https://www.youtube.com/watch?v=miEngVBrrIc
https://www.youtube.com/watch?v=iSCV_XFcVPU
https://www.youtube.com/watch?v=Cuyp1bvuaxA
https://www.youtube.com/watch?v=41IfdwLqtkA
https://www.youtube.com/watch?v=FNIoKmMq6cs
https://www.youtube.com/watch?v=SsSHzTsG4wY
https://www.youtube.com/watch?v=Me5LFbPrEe0
https://www.youtube.com/watch?v=r7rKKFOui8w
https://www.youtube.com/watch?v=Lt3cY9i7kgQ
https://www.youtube.com/watch?v=LScfRoudcC4











 Lähde: https://www.hindawi.com/journals/jnme/2018/7195760/
Lähde: https://www.hindawi.com/journals/jnme/2018/7195760/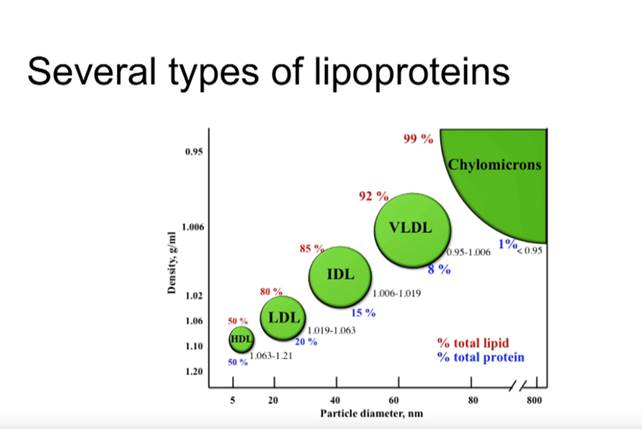
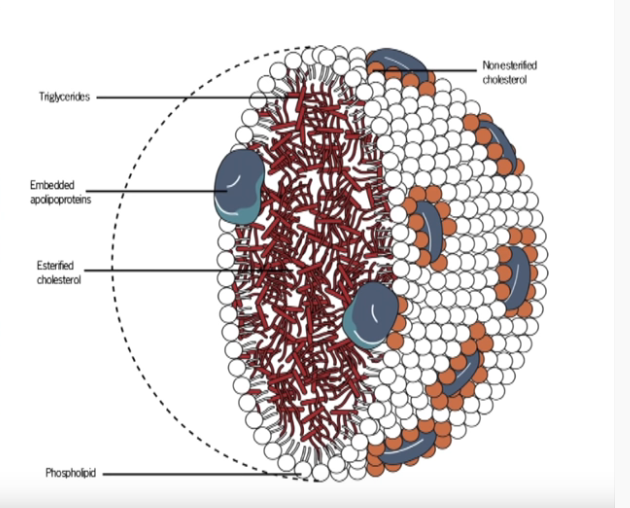

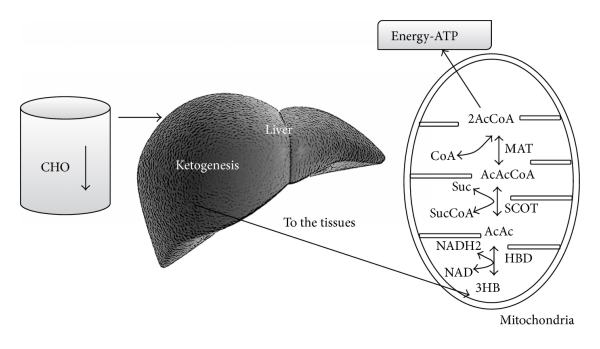 Keskushermostossa glukoosia tarvitaan energia lähteeksi, sekä tuottamaan pyruvaatteja, jotka voidaan edelleen muuntaa oksaloasetaatiksi.
Keskushermostossa glukoosia tarvitaan energia lähteeksi, sekä tuottamaan pyruvaatteja, jotka voidaan edelleen muuntaa oksaloasetaatiksi.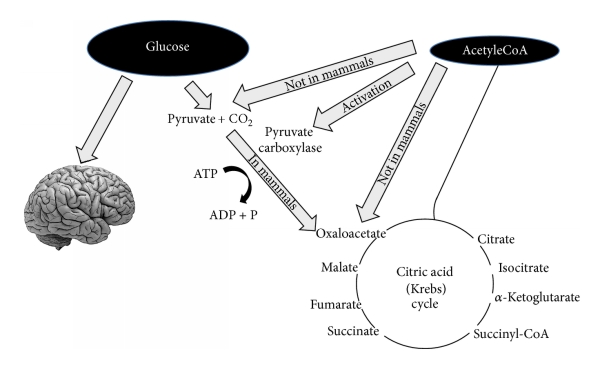












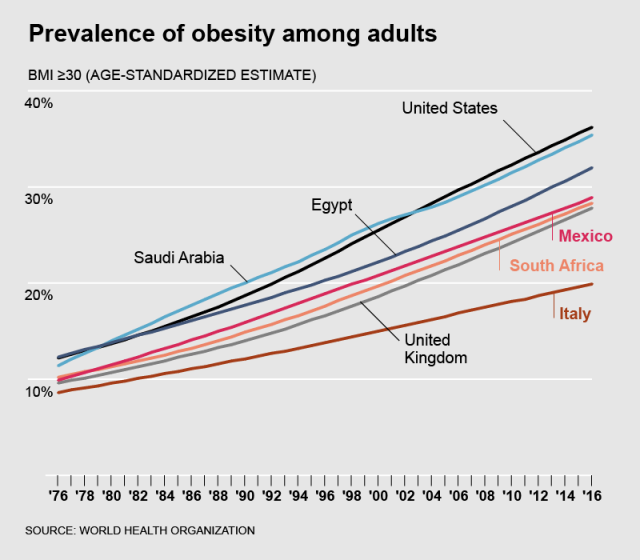
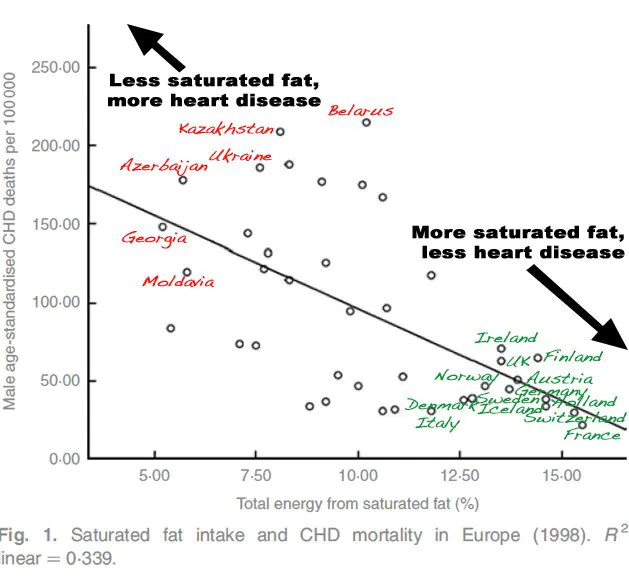





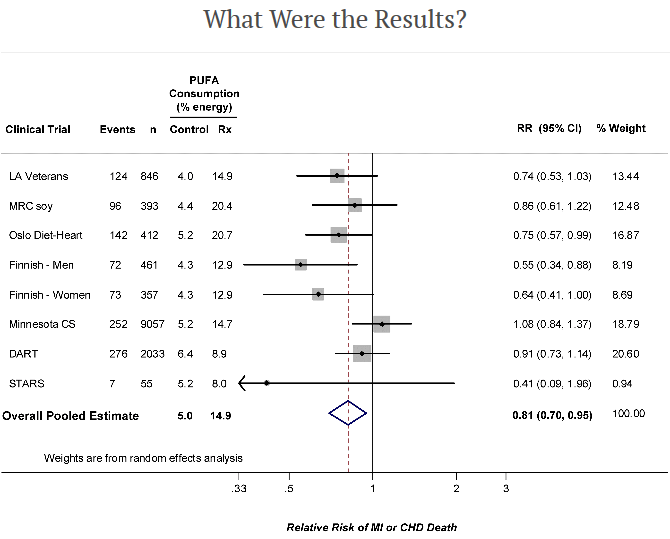



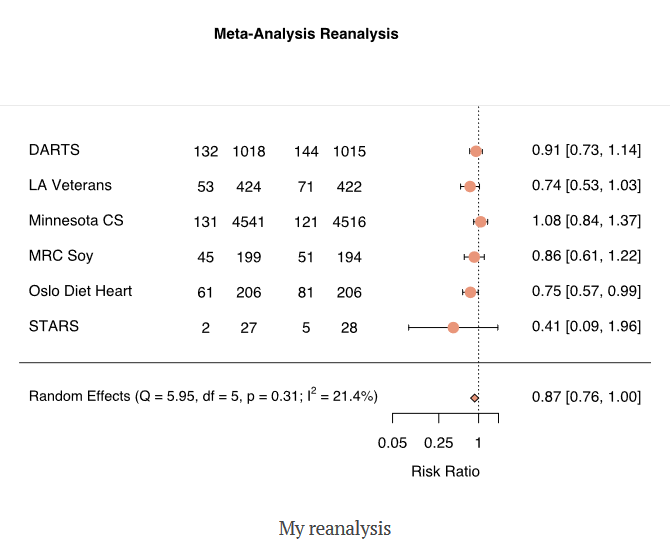
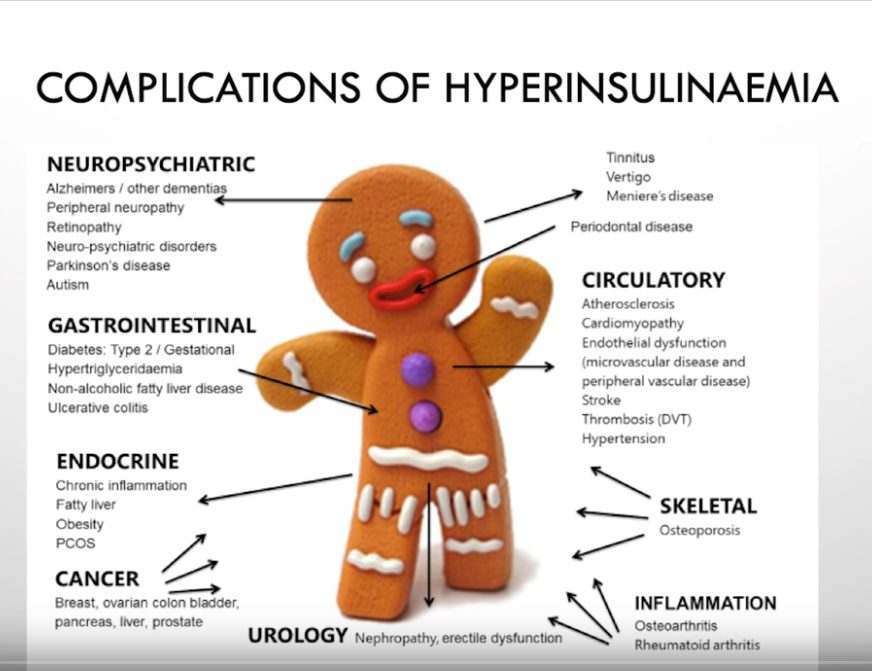
 Lihavuuden yleistyminen
Lihavuuden yleistyminen

 60– ja 70-luvuilla rasvojen terveysvaikutuksista tehtiin kiinnostavia kontrolloituja satunnaistettuja tutkimuksia (CRT). Nämä tutkimukset eivät kuitenkaan mahtuneet vallitsevaan hypoteesiin kovien rasvojen haitallisuudesta, joten ne niiden annettiin unohtua.
60– ja 70-luvuilla rasvojen terveysvaikutuksista tehtiin kiinnostavia kontrolloituja satunnaistettuja tutkimuksia (CRT). Nämä tutkimukset eivät kuitenkaan mahtuneet vallitsevaan hypoteesiin kovien rasvojen haitallisuudesta, joten ne niiden annettiin unohtua.