Ketogeeninen ruokavalio, sydän- ja verisuonitaudit 1: lipidit
Laajan tieteellisen näytön yhteenvetona voidaan todeta, että ketogeeninen ruokavalio (KD) on lupaava ravitsemusmalli sydän- ja verisuonitautien ehkäisyyn ja hoitoon. Tutkimukset vahvistavat KD:n enimmäkseen hyödylliset vaikutukset lipidiprofiiliin ja muihin sydän- ja verisuonitautien riskitekijöihin.
Pleiotrooppisten ominaisuuksiensa ansiosta ketogeeninen ruokavalio vaikuttaa sydän- ja verisuonijärjestelmään useilla tasoilla. Ketogeenisen ruokavalion mahdollinen etu on sen tulehdusta hillitsevä vaikutus, joka on vuorovaikutuksessa sydäntä suojaavien ominaisuuksien kanssa.
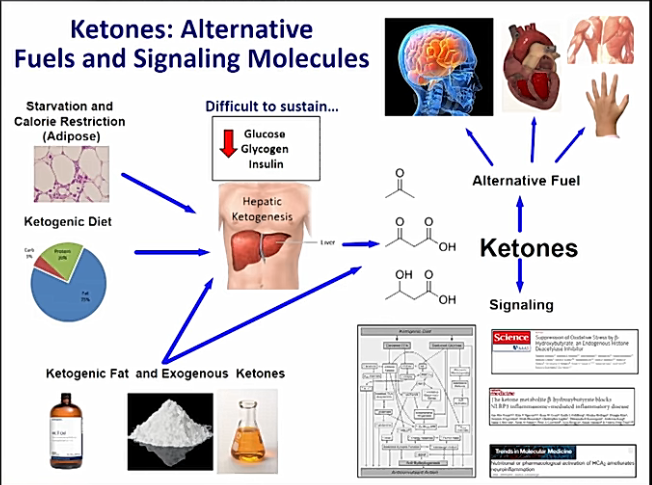
Vaikutus sydänlihassolujen aineenvaihduntaan ja ketoaineiden lisääntynyt otto sydänsairauksissa tarkoittaa, että ketoaineita voidaan kuvailla sydämen ”pelastuspolttoaineeksi”.
Ketogeenisen ruokavalion monitahoiset vaikutukset voidaan vahvistaa myös ketoaineiden vaikutuksella verisuonten endoteeliin. Ketoaineet moduloivat verisuonten endoteelisoluja, parantavat niiden toimintaa tai hidastavat niiden ikääntymistä. Tämä vahvistaa myös ketogeenisen ruokavalion hyödyllisen vaikutuksen verenpainearvoihin ja muihin epäsuoriin sydän- ja verisuonitautien riskitekijöihin, kuten ylipainon vähenemiseen.
Useat näistä tekijöistä vaikuttavat ketogeenisen ruokavalion yleiseen sydäntä suojaavaan potentiaaliin sydän- ja verisuonisairauksien ehkäisyssä ja hoidossa. Yhä useammat viimeaikaiset tieteelliset tutkimukset vahvistavat tämän.
Kirjoittajat: Damian Dyńka , Katarzyna Kowalcze , Anna Charuta , Agnieszka Paziewska ,*
Alkuperäinen artikkeli: https://pmc.ncbi.nlm.nih.gov/articles/PMC10421332/
Käännös & editointi: Sami Raja-Halli
Tiivistelmä
Sydän- ja verisuonitaudit ovat maailman yleisin kuolinsyy. Ruokavalio on keskeinen tekijä sydän- ja verisuonitautien synnyssä. Tämän kirjallisuuskatsauksen tavoitteena on arvioida ketogeenisen ruokavalion potentiaalia sydän- ja verisuonitautien ehkäisyssä ja hoidossa. Katsauksessa huomioidaan uusimmat saatavilla olevat tutkimukset.
Ketogeenisellä ruokavaliolla on monitahoinen vaikutus sydän- ja verisuonitautien ehkäisyssä ja hoidossa. Sillä on muun muassa hyödyllinen vaikutus veren lipidiprofiiliin, jopa verrattuna muihin ruokavalioihin.
KD:llä on tulehdusta estävä ja sydäntä suojaava potentiaali, joka johtuu muun muassa ketoosin anti-inflammatorisista ominaisuuksista, yksinkertaisten sokereiden poistamisesta, hiilihydraattien kokonaismäärän rajoittamisesta ja omega-3-rasvahappojen saannista. Ketogeeninen ruokavalio vaikuttaa myönteisesti myös verenpaineeseen, verisuonten endoteelin terveyteen ja muihin sydän- ja verisuonitautien riskitekijöihin.
1. Johdanto
Sydän- ja verisuonitaudit ovat maailman yleisin kuolinsyy. Niiden seurauksena kuolee keskimäärin 17,9 miljoonaa ihmistä vuosittain [1]. Vuonna 2020 sydän- ja verisuonitautien aiheuttamien kuolemien määrä oli yli 19 miljoonaa (merkittävä 18,7 prosentin kasvu vuodesta 2010) [2].
Tilastot osoittavat vaarallista kasvua vuodesta 1990 vuoteen 2019. Tänä aikana sydän- ja verisuonitautikuolemat nousivat 12,1 miljoonasta 18,6 miljoonaan [3]. Vertailun vuoksi: syövät tappavat vuosittain n. 10 miljoonaa ihmistä [4]. Vuonna 2006 julkaistu arvio ennusti vuosittain jopa 23,3 miljoonaa sydän- ja verisuonitautikuolemaa vuoteen 2030 mennessä [5].
Sydän- ja verisuonisairauksiin kuuluvat:
- sepelvaltimotauti
- sydämen vajaatoiminta
- sydämen rytmihäiriöt
- aivoverisuonisairaudet
- sydämen läppävika
- sydänpussin tulehdus
- kardiomyopatia (sydänlihassairaus)
- synnynnäiset sydänviat
- reumaattiset sydänsairaudet
- äkillinen sydänpysähdys
- ateroskleroosi
- sydäninfarktit
- aivohalvaukset
- dyslipidemia
- kohonnut verenpaine ja muita [2].
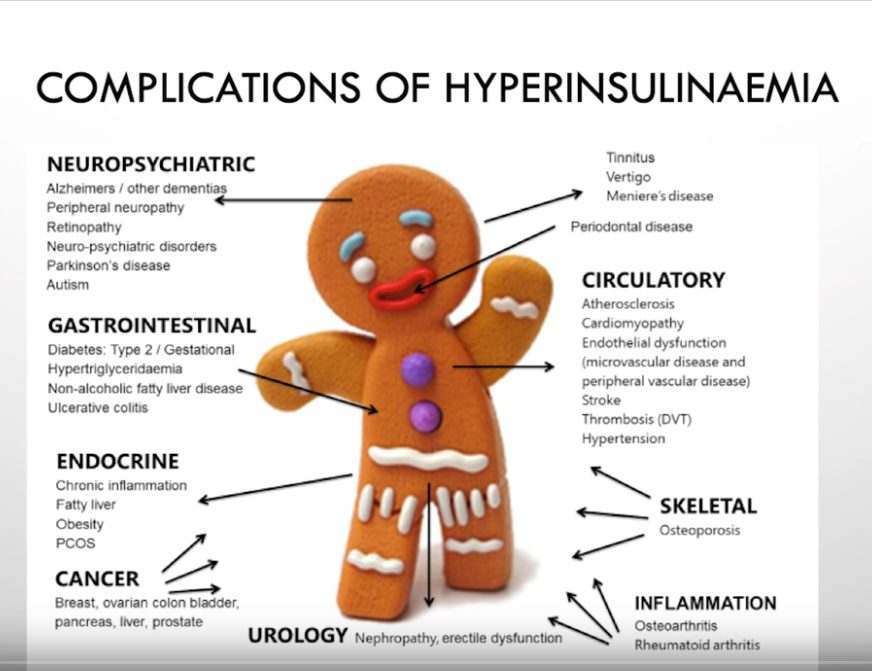
Huono ruokavalio, puutteellinen liikunta, tupakointi, alkoholinkäyttö, ylipaino ja lihavuus, diabetes, kroonnen stressi ja D-vitamiinin puutos kasvattavat sydän- ja verisuonitautien riskiä. Kohonnut verenpaine on itsessään sairaus, mutta epäsuorasti se lisää merkittävästi myös muiden sydän- ja verisuonisairauksien kehittymisen riskiä. Liiallinen natriumin saanti ja korkeat seerumin LDL-lipoproteiinipitoisuudet tunnistetaan myös riskitekijöiksi [1,6,7,8]. Toisaalta toiset (mukaan lukien homokysteiini, natriumkloridin puutteellinen saanti) jäävät usein huomiotta, vaikka ne saattavat usein olla merkityksellisempiä indikaattoreita [9,10,11].
Ruokavaliolla on keskeinen rooli sydän- ja verisuonitaudeissa. Se itsessään on tärkeä tekijä sydän- ja verisuonitautien ehkäisyssä ja hoidossa ja toisaalta vaikuttaa epäsuoriin riskitekijöihin [12,13].
Sydän- ja verisuonitautien ehkäisyyn ja hoitoon suositeltu ruokavalio sisältää runsaasti vihanneksia, hedelmiä, kalaa, palkokasveja ja täysjyvätuotteita [14]. Tämä on linjassa muun muassa Välimeren ja DASH-ruokavalioiden rakenteen (spesifisyyden) kanssa [15,16,17,18].
Ketogeeninen ruokavalio on erilainen lähestymistapa sydän- ja verisuonitautien ehkäisyssä ja hoidossa. KD:llä kehon pääasiallinen energianlähde ovat rasvoista tuotetut ketoaineet (asetoni, asetoasetaatti ja betahydroksibutyraatti).
Ravitsemuksellisen ketoosin saavuttamiseksi rasvasta saatavan energian osuus on 70–80 % (jopa 90 % kliinisessä versiossa, jota käytetään epilepsian hoidossa), proteiinin osuus on noin 20 %, ja hiilihydraattien määrä 20-50 g päivässä [19].
Rasvojen huonon maineen vuoksi KD:n vaikutuksesta sydän- ja verisuonisairauksiin on paljon kiistaa.
American Heart Associationin (AHA) mukaan KD herättää sydän- ja verisuonitautiin liittyvää kiistaa, eikä se ole kovin linjassa AHA:n ruokavaliosuositusten kanssa [20]. Tieteelliset havainnot kuitenkin viittaavat siihen, että KD voi olla lupaava suunta jatkotutkimukselle.
2. Ketogeeninen ruokavalio ja veren lipidiprofiili
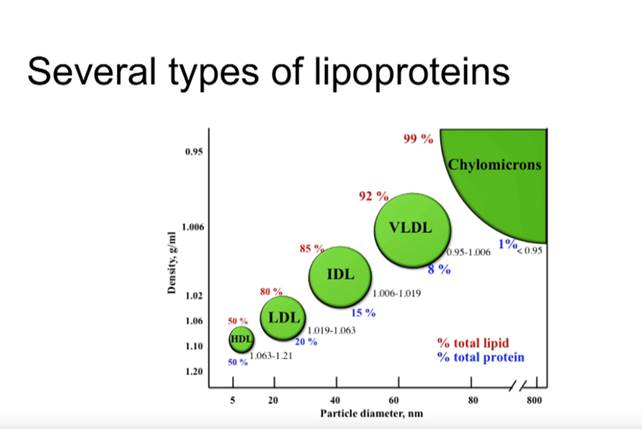
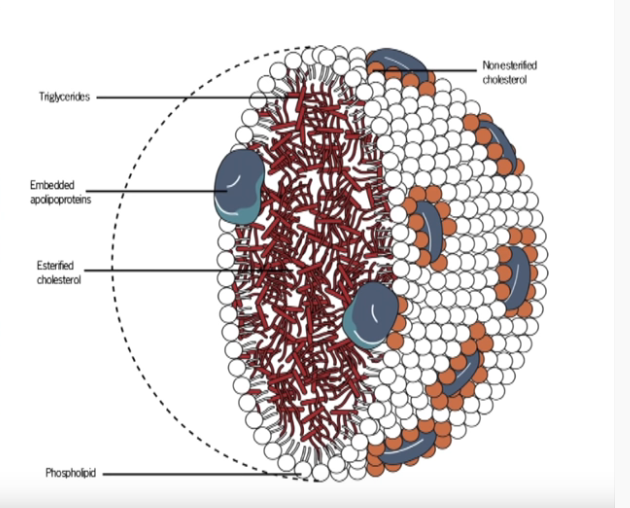
Veren lipidiprofiilia tutkitaan yleensä neljän parametrin muodossa: kokonaiskolesteroli (TC), matalatiheyksinen lipoproteiini (LDL), korkeatiheyksinen lipoproteiini (HDL) ja triglyseridit (TG). Näiden poikkeavuuksia (dyslipidemia) pidetään yhtenä tärkeimmistä sydän- ja verisuonitautien riskitekijöistä [21].
2.1. Veren lipidit sydän- ja verisuonitaudeissa
Maailman terveysjärjestö WHO listaa korkean kokonaiskolesterolin yhdeksi näiden sairauksien riskitekijöistä [1]. Vuonna 2022 julkaistussa tutkimuksessa havaittiin yhteys korkeampien kokonaiskolesterolitasojen ja lisääntyneen sydän- ja verisuonitautikuolleisuuden välillä [22]. Toinen prospektiivinen 10 vuoden kohorttitutkimus osoitti, että iskeemisen sydänsairauden riski oli suurin kokonaiskolesterolitasoilla <155 mg/dl ja >185 mg/dl [23].
|
Suomessa veren kolesteroliarvot ilmoitetaan yleensä mmol/l (millimoolia litrassa). Luvut 155 mg/dl ja 185 mg/dl ovat Yhdysvalloissa ja joissakin muissa maissa yleisesti käytetty yksikkö (milligrammaa desilitrassa). Näiden yksiköiden välillä on kiinteä muuntosuhde. Kun halutaan muuntaa mg/dl-arvo mmol/l-arvoksi, se jaetaan luvulla 38,67.
Suomessa kokonaiskolesterolin tavoitearvot ovat alle 5,0 mmol/l. Tutkimuksen ”riskialueet” sijoittuvat suomalaisten suositusarvojen sisään. |
Iskeemisen sydänsairauden riski voi olla suuri matalilla ja korkeilla kokonaiskolesterolitasoilla. Tämä ilmiö tunnetaan kirjallisuudessa usein U-muotoisena tai J-muotoisena yhteytenä, mikä eroaa yleisesti tunnetusta ajatuksesta, että matalampi kolesteroli on aina parempi. Yhteys voi johtua ”käänteisestä kausaliteetista” (reverse causality), jossa matala kolesteroli on muiden, vakavampien terveysongelmien, kuten tulehdustilojen tai aliravitsemuksen, seurausta, eikä suora syy iskeemiseen sydänsairauteen.
Vaikka korkea kolesteroli on tunnettu riskitekijä ateroskleroosille ja iskeemiselle sydänsairaudelle, jotkin tutkimukset ovat havainneet, että myös matala kolesterolitaso voi liittyä lisääntyneeseen riskiin.
Tutkimustulosten välillä on eroja erilaisista tutkimusmenetelmistä johtuen. Prospektiivisessa kohorttitutkimuksessa, johon osallistui 12,8 miljoonaa aikuista, havaittiin, että alhaisin kuolleisuus mistä tahansa syystä liittyi kokonaiskolesterolitasoihin 210–249 mg/dl (5,4 mmol-6,4 mmol/l). Tämä päti kaikkiin ikäryhmiin ja sukupuoliin lukuun ottamatta 18–34-vuotiaita miehiä ja naisia: 180–219 mg/dl miehillä (4,66–5,67 mmol/l) ja 160–199 mg/dl naisilla (4,14–5,15 mmol/l ) ja 35–44-vuotiaita naisia: 180–219 mg/dl (4,66–5,67 mmol/l ) [24].
British Heart Foundation ja Maailman terveysjärjestö esittivät vastaavia tuloksia jo vuonna 2005, jotka perustuivat 164 maasta eri puolilta maailmaa kerättyihin tietoihin. Ne osoittivat, että alhaisin kuolleisuus mistä tahansa syystä johtuen liittyi kokonaiskolesterolipitoisuuksiin välillä 200 mg/dl ja 240 mg/dl (5,2 mmol/l-6,2 mmol/l). Alhaisin kuolleisuus sydän- ja verisuonitauteihin oli välillä 190–225 mg/dl (4,9 mmol/l-5,8 mmol/l) [25].
Toisen julkaisun kirjoittajat nostivat esiin metodologisia virheitä (ml. ristiriitaisen tiedon huomiotta jättäminen ja harhaanjohtavien tilastojen käyttö) tutkimuksissa, jotka viittasivat korkeampiin kokonaiskolesteroli- ja LDL-pitoisuuksiin sydän- ja verisuonitautien tärkeimpänä syynä [26].
Suuritiheyksistä lipoproteiinia (HDL) pidetään yleensä ”hyvänä kolesterolina”. Toisin kuin matalatiheyksistä lipoproteiinia (LDL), HDL-pitoisuuden nousua pidetään hyödyllisenä [33]. Tutkimukset osoittavat, että se korreloi käänteisesti sydän- ja verisuonitautikuolleisuuteen [22], vaikka sekä liian alhaiset että liian korkeat pitoisuudet voivat joidenkin tutkimusten mukaan olla terveyden kannalta epäedullisia [34,35].
Korkeiden triglyseriditasojen katsotaan myös lisäävän sydän- ja verisuonitautiriskiä [36]. Vuonna 2021 tehdyssä 10 vuotta kestäneessä kohorttitutkimuksessa havaittiin merkittävä, lineaarinen yhteys triglyseridipitoisuuksien ja iskeemisen aivohalvauksen välillä.
Näyttää siltä, että tässäkin tapauksessa liian alhaiset pitoisuudet (<80 mg/dl eli 2,07 mmol/l) voivat liittyä lisääntyneeseen kuolemanriskiin mistä tahansa syystä [23]. Triglyseridiparadoksiksissa triglyseridipitoisuudet korreloivat käänteisesti mistä tahansa syystä johtuvaan kuolleisuuteen, jopa sydän- ja verisuonitautipotilailla [37,38].
TG/HDL-suhde itsessään voi olla paljon merkityksellisempi sydän- ja verisuonitautiriskin ennustamisessa kuin pelkkä TG-pitoisuus [39].
Vuonna 2023 julkaistu tutkimus osoitti, että residuaalikolesteroli on itsenäinen (ja mahdollisesti aikaisempi kuin LDL) ateroskleroosin riskitekijä [40]. Toinen tutkimus vahvisti, että sekä residuaalikolesteroli että LDL-kolesteroli olivat yhtä lailla yhteydessä iskeemisen sydäntaudin riskiin. Tästä huolimatta vain residuaalikolesterolitasot (ei paastossa mitatut) liittyivät lisääntyneeseen kuolemanriskiin mistä tahansa syystä [41]. Toinen tutkimus esitti, että apolipoproteiini B:n (Apo B) ja apolipoproteiini AI:n (Apo A-I) suhde oli paljon parempi ennustaja sydän- ja verisuonitautiriskin arvioinnissa. Muiden parametrien, kuten kokonaiskolesterolin, LDL:n, triglyseridien sekä kokonaiskolesterolin/HDL-kolesterolin, triglyseridien/HDL-kolesterolin ja LDL-kolesterolin/HDL-kolesterolin suhteiden, merkitystä ei osoitettu [42].
2.2. Ketogeenisen ruokavalion vaikutus veren lipideihin
Ketogeenisen ruokavalion vaikutuksesta veren lipidiprofiiliin kiistellään. Ristiriitaista tietoa on paljon, mikä voi johtua joidenkin faktojen ja tutkimusmenetelmien väärinymmärryksestä. KD-ruokavalion runsasrasvainen (usein korkea kolesteroli) luonne myötävaikuttaa tähän. Kulutetun rasvan ja kolesterolin määrän ja tyypin vaikutuksesta veren lipidiprofiiliin on paljon kiistaa.
2022 julkaistun RCT:n (satunnaistettu, kontrolloitu tutkimus) tekijät vertasivat ketogeenisen ruokavalion (KD) ja tavanomaisen diabetesruokavalion (SDD/standard diabetes diet) vaikutusta ylipainoisilla ja lihavilla potilailla, joilla oli äskettäin diagnosoitu tyypin 2 diabetes.
Lipidiprofiilin perusteella ketogeeninen ruokavalio oli SDD-ruokavaliota parempi. Tuloksia:
- Kokonaiskolesteroli laski ketogeenisellä ruokavaliolla enemmän kuin tavannomaista diabetesruokavaliota (SDD) noudattaneilla.
KD: 4,54 ± 0,69 mmol/l:sta 4,02 ± 0,43 mmol/l:aan vs. SDD: 4,56 ± 0,67 mmol/l:sta 4,23 ± 0,47 mmol/l:aan - muutos triglyserideissä oli KD-ruokavaliota noudattavassa ryhmässä SDD-ryhmää parempi
KD: 1,76 ± 0,59 mmol/l:sta 1,44 ± 0,26 mmol/l:aan vs. SDD: 1,81 ± 0,78 mmol/l:sta 1,66 ± 0,46 mmol/l:aan. - LDL-kolesterolin osuus laski KD–ruokavaliolla enemmän kuin SDD-ruokavaliolla:
2,75 ± 0,65 mmol/l:sta 2,34 ± 0,45 mmol/l:aan vs. 2,77 ± 0,69 mmol/l:sta 2,59 ± 0,58 mmol/l:aan - Lisäksi HDL-kolesterolin osuus muuttui KD:llä suotuisammaksi:
1,08 ± 0,11 mmol/l:sta 1,21 ± 0,23 mmol/l:aan verrattuna 1,09 ± 0,19 mmol/l:sta 1,12 ± 0,20 mmol/l:aan tavanomaista diabetesruokavaliota noudattaneilla) [43]
Vaikka molemmissa ryhmissä kalorienkulutus oli 1500 ± 50 kcal, KD:tä noudattaneiden osallistujien paino laski keskimäärin 78,32 ± 15,27:stä 70,26 ± 14,79:ään 12 viikon aikana. Tavanomaista diabetesruokavaliota käyttäneiden osallistujien paino ei käytänössä muuttunut (keskimäärin 77,95 ± 14,76 kg:sta 77,34 ± 13,28 kg:aan).
Suuremmat hyödyt lipidiprofiilin muutoksissa voivat myös johtua suoraan painonpudotuksesta KD:tä noudattaneilla osallistujilla. Lisäksi siihen on voinut vaikuttaa myös itse ruokavalion koostumus, jossa oli merkittävä osuus tyydyttymättömiä rasvahappoja oliiviöljystä, avokadosta ja kalasta.
Toisessa vuonna 2022 tehdyssä satunnaistetussa kontrolloidussa tutkimuksessa verrattiin hyvin muotoillun ketogeenisen ruokavalion (WFKD) ja Välimeren plus-ruokavalion (Med-Plus) vaikutusta diabeetikoilla ja esidiabeetikoilla.
Ketogeenisen ruokavalion hyödyt osoitettiin triglyseridien suurempana laskuna 118,8 mg/dl:sta 99,5 mg/dl:aan (Med-Plus-ryhmässä 131,1 mg/dl:sta 121,7 mg/dl:aan) ja HDL-kolesterolin suurempana nousuna 49,1 mg/dl:sta 54,1 mg/dl:aan (Med-Plus-ryhmässä 48 mg/dl:sta 47,9 mg/dl:aan).
Triglyseridit:
- WFKD 118,8 mg/dl = 1,34 mmol/l → 99,5 mg/dl = 1,12 mmol/l
- MedPlus 131,1 mg/dl = 1,48 mmol/l → 121,7 mg/dl = 1,37 mmol/l
HDL-kolesteroli:
- WFKD 49,1 mg/dl = 1,27 mmol/l → 54,1 mg/dl = 1,40 mmol/l
- MedPlus 48,0 mg/dl = 1,24 mmol/l → 47,9 mg/dl = 1,24 mmol/l
Tutkimus osoitti kuitenkin LDL-kolesterolin osuuden nousua (97,8 mg/dl:sta 111,3 mg/dl:aan) ketogeenistä ruokavaliota noudattaneilla, kun taas Med-Plus-ryhmässä se laski (111,5 mg/dl:sta 95,3 mg/dl:aan) [44].
- WFKD: LDL-kolesteroli nousi 97,8 mg/dl:sta (2,53 mmol/l) → 111,3 mg/dl:aan (2,88 mmol/l).
- Med-Plus-ryhmä: LDL-kolesteroli laski 111,5 mg/dl:sta (2,89 mmol/l) → 95,3 mg/dl:aan (2,47 mmol/l).
Vuonna 2022 toteutettiin kontrolloitu satunnaistettu tutkimus, jossa arvioitiin muiden tekijöiden ohella ketogeenisen ruokavalion vaikutusta vaikeaa obstruktiivista uniapneaoireyhtymää sairastavien potilaiden lipidiprofiiliin.
Myös tämä tutkimus osoitti, että KD-ruokavaliolla on suotuisa vaikutus potilaiden lipidiprofiileihin, mikä havaittiin muiden tekijöiden ohella:
-
- kokonaiskolesterolin laskuna 200,1±30,1 mg/dl (5,17±0,78 mmol/l) tasolle 180,4±35,2 mg/dl (4,66±0,91 mmol/l)
- LDL:n laskuna 127,4 ± 26,8 mg/dl ( 3,29±0,69 mmol/l) arvoon 107,1 ± 37,1 mg/dl (2,77±0,96 mmol/l) ja
- triglyseridien laskuna arvosta 191 ± 41,7 mg/dl (2,16±0,47 mmol/l) arvoon 130 ± 79 mg/dl (1,47±0,89 mmol/l).
Samalla on syytä mainita, että nämä tulokset olivat seurausta vähäkalorisen ketogeenisen ruokavalion (LCKD) samanaikaisesta käytöstä jatkuvan positiivisen hengitystiepaineen (CPAP) kanssa. Tulokset olivat parempia kuin pelkkään CPAP-hoitoon rajoittuneen intervention tulokset.
HDL-kolesterolin osuus ei muuttunut merkittävästi kummassakaan ryhmässä [45]. CPAP + LCKD -ryhmässä havaitut suuremmat hyödyt saattavat kuitenkin johtua suuremmasta painonpudotuksesta (keskimäärin 143,6 ± 23,6 kg:sta 129,7 ± 23,7 kg:aan vs. CPAP-ryhmän keskiarvosta 132,7 ± 23 kg:sta 131,6
Toisessa satunnaistetussa kontrolloidussa tutkimuksessa koulutetuilla miehillä ei havaittu merkittäviä eroja lipidiprofiilin muutoksissa ketogeenisen (KD) ja ei-ketogeenisen (NKD) ruokavalion välillä [46].
Tämän RCT:n tekijät totesivat, että ketogeeninen ruokavalio nosti LDL-kolesterolitasoja kaikilla terveillä, normaalipainoisilla nuorilla naisilla hoitovaikutuksen ollessa 1,82 mM (p < 0,001). Ruokavalio nosti myös pienen tiheän LDL-kolesterolin ja suuren kelluvan LDL-kolesterolin pitoisuuksia. Lisäksi havaittiin apolipoproteiini B-100:n (ApoB) nousua. Kirjoittajat päättelivät siksi, että ketogeeninen ruokavalio tässä tapauksessa osaltaan heikensi veren lipidiprofiilia tutkituilla naisilla [47]. Tämä on yksi niistä tutkimuksista, joissa ei havaittu painonpudotusta, mikä paransi muissa tutkimuksissa saattoi korreloida merkittävästi kehon lipidiprofiiliin.
Yksityiskohtaiset tulokset on esitetty taulukossa 1. On myös tehty satunnaistettu kontrolloitu tutkimus, jossa tutkittiin omega-3-rasvahappolisän vaikutusta Välimeren ketogeeniseen ruokavalioon ja joihinkin sydän- ja verisuonitautien riskitekijöihin. Tärkeää on, että sekä pelkkä Välimeren ketogeeninen ruokavalio että omega-3-rasvahappolisällä rikastettu ruokavalio pystyivät alentamaan kokonaiskolesterolia, triglyseridejä ja LDL-kolesterolia sekä lisäämään HDL-kolesterolia [52].
Toisen satunnaistetun kontrolloidun tutkimuksen tekijät tutkivat ketogeenisen ruokavalion vaikutusta lihaviin lapsiin ja nuoriin. Osoitettiin, että ketogeeninen ruokavalio lisäsi HDL-kolesterolipitoisuuksia jossain määrin ja alensi triglyseridipitoisuuksia. Samalla se kuitenkin lisäsi myös kokonaiskolesterolia ja LDL-kolesterolipitoisuuksia, mikä viittaa vaihteleviin tuloksiin [53].
Saslow ym. raportoivat 12 kuukautta kestäneen satunnaistetun tutkimuksen tulokset kohtalaisen tai hyvin vähähiilihydraattisesta ruokavaliosta ylipainoisilla aikuisilla, joilla on tyypin 2 diabetes tai esidiabetes. Tulokset vahvistivat ketogeenisen ruokavalion hyödyt triglyseridi- ja HDL-kolesterolipitoisuuksiin sekä kuuden kuukauden että kokonaisen vuoden kuluttua. On kuitenkin huomionarvoista, että LDL-kolesterolin osuusarvot olivat nousseet tänä aikana [51], joten tulokset eivät olleet selkeitä.
Kirjoittaja väittää, että vaikka monet tutkimukset osoittavat yhteyden LDL-kolesterolin ja sydän- ja verisuonitautien välillä, tämä ei ole ratkaiseva syy-yhteyden osoittaja [48].
Eräässä toisessa satunnaistetussa kontrolloidussa tutkimuksessa raportoitiin ketogeenisen ruokavalion suotuisasta vaikutuksesta lipidiprofiiliin, mukaan lukien LDL-kolesterolin osuusarvon lasku. Hyötyjä havaittiin riippumatta kulutetun proteiinin tyypistä – heraproteiinia, eläinproteiinia ja kasviproteiinia nauttivissa ryhmissä. LDL-kolesterolin merkittävän laskun lisäksi kokonaiskolesteroli ja triglyseridit laskivat merkittävästi. HDL-kolesteroli ei kuitenkaan muuttunut paljon [49].
Hyperinsulinemiaa ja ylipainoa sairastavilla naisilla tehty satunnaistettu kontrolloitu tutkimus osoitti, että HDL-pitoisuudet nousivat vähäkalorista ketogeenistä ruokavaliota (LCKD) noudattaneilla naisilla, arvosta 36,71 ± 4,42 mg/dl (0,95 ± 0,11 mmol/l) arvoon 52,99 ± 7,77 mg/dl (1,37 ± 0,20 mmol/l).
Tämä oli merkittävästi parempi kuin kontrolliryhmässä (CG), jossa HDL-tasoissa ei havaittu merkittävää muutosta (arvosta 44,14 ± 5,07 (1,14 ± 0,13 mmol/l) arvoon 43,01 ± 5,03 mg/dl (1,11 ± 0,13 mmol/l).
Lisäksi triglyseridit (TG) LCKD-potilailla laskivat arvosta 213,45 ± 63,60 mg/dl (2,41 ± 0,72 mmol/l) arvoon 129,13 ± 46,23 mg/dl (1,46 ± 0,52 mmol/l) verrattuna kontrolliryhmään arvosta 210,57 ± 36,45 mg/dl (2,38 ± 0,41 mmol/l) arvoon 206,44 ± 50,03 mg/dl (2,33 ± 0,56 mmol/l) [50].
Havaitut muutokset saattoivat johtua pelkästään painonpudotuksesta (89,08 ± 14,68 kg:sta 75,36 ± 13,47 kg:aan vs. 90,63 ± 11,04 kg:sta 89,86 ± 11,30 kg:aan CG-ryhmässä) ja vyötärön ympärysmitan pienenemisestä LCKD-ryhmässä (101,04 ± 11,86 cm:stä 87,34 ± 9,50 cm:iin vs. 102,93 ± 10,32 cm:stä 103,67 ± 9,79 cm:iin CG-ryhmässä). Tämä johtui mahdollisesti siitä, että ryhmien kalorien saanti ei ollut samanarvoinen.
Heterogeeniset tulokset satunnaistetuissa kontrolloiduissa tutkimuksissa johtavat yksimielisyyden puutteeseen julkaistuissa meta-analyyseissä ja systemaattisissa katsauksissa.
Yhdessä meta-analyysissä kirjoittajat vertasivat ketogeenisen ruokavalion ja perinteisten ei-ketogeenisten ruokavalioiden hyötyjä syöpäpotilailla. Yksi tutkituista indikaattoreista oli lipidiprofiili. Ketogeenisen ruokavalion osoitettiin alentavan triglyseridejä (WMD = −24,46 mg/dl; 95 %:n luottamusväli: −43,96; −4,95; ja p = 0,014) ja osoittavan merkityksetöntä hyödyllistä vaikutusta kolesteroliin [54].
Toisessa meta-analyysissä kirjoittajat totesivat, että ketogeenistä ruokavaliota noudattavilla tyypin 2 diabeetikoilla ei ollut yhteyttä kokonaiskolesterolin tai LDL-fraktion nousuun tai HDL-fraktion laskuun. Lisäksi triglyseridipitoisuudet laskivat ketogeenisen ruokavalion jälkeen verrattuna kontrolliryhmään (SMD = −0,49, 95 %:n luottamusväli: −0,82 – −0,17, p = 0,003) [55].
Vuonna 2022 tehdyn meta-analyysin tulokset osoittivat, että ketogeeninen ruokavalio oli jopa 12 kuukauden ajan tehokkaampi (verrattuna kontrolliryhmään) triglyseridien alentamisessa ja HDL-kolesterolin lisäämisessä [56].
Yuan ym. tekivät useiden tutkimusten meta-analyysin, jossa verrattiin tyypin 2 diabeetikkojen parametreja ennen ketogeenistä ruokavaliota ja sen jälkeen. Triglyseridien osoitettiin laskevan keskimäärin 0,72 (95 %:n luottamusväli: −1,01 – −0,43), kokonaiskolesterolin 0,33 (95 %:n luottamusväli: −0,66 – −0,01) ja LDL:n 0,05 (LV: −0,25 – −0,15) KD-hoidon jälkeen, kun taas HDL-pitoisuudet nousivat 0,14 (95 %:n luottamusväli: 0,03 – 0,25). Tämän perusteella meta-analyysin tekijät päättelivät, että KD:llä oli hyödyllinen vaikutus lipidiparametrien parantamisessa tyypin 2 diabetesta sairastavilla potilailla [57].
López-Espinozan ym. meta-analyysin tulokset eivät osoittaneet ketogeenisen ruokavalion (KD) tuovan lihavilla potilailla suurempia etuja verrattuna tasapainoiseen ruokavalioon [58].
Sen sijaan meta-analyysi, jossa arvioitiin erittäin vähäkalorisen ketogeenisen ruokavalion (VLCKD) potentiaalia lihavuuden hoidossa, osoitti sen olevan parempi kuin muut ruokavaliot parantamalla useita parametreja, mukaan lukien kokonaiskolesteroli ja triglyseridit. Merkittäviä LDL-kolesterolin laskuja havaittiin myös, mutta ne olivat samankaltaisia kuin muiden painonpudotusmenetelmien yhteydessä havaitut muutokset [59].
Castellana ym. arvioivat myös VLCKD:n tehoa ja turvallisuutta ylipainoisilla ja lihavilla potilailla. Kirjoittajat totesivat, että VLCKD:n avulla kokonaiskolesteroli väheni keskimäärin 28 mg/dL (-0,72 mmol/l) ja triglyseridit 30 mg/dL (-034 mmol/l), kun taas HDL- ja LDL-kolesterolifraktioissa ei ollut merkittäviä muutoksia [60].
Ketogeenisessä ruokavaliossa korkea kolesterolin saanti mainitaan usein kohonneiden seerumin kolesterolitasojen syyksi. Olemassa ei kuitenkaan ole vahvaa ja yksiselitteistä näyttöä siitä, että seerumin kolesterolitaso nousisi ruoasta saatavan kolesterolin lisääntymisen vuoksi.
Säätelymekanismien ansiosta elimistö pystyy ottamaan tarvitsemansa määrän kolesterolia. Itse asiassa edes 25 kananmunan (joiden tiedetään sisältävän paljon kolesterolia) syöminen päivässä 15 vuoden ajan ei johtanut epänormaaliin lipidiprofiiliin 88-vuotiaalla potilaalla [61].
Ravinnon kolesterolin saannin yläraja poistettiin vuonna 2015 Yhdysvaltain maatalousministeriön (USDA) suosituksista. Viimeaikaiset julkaisut vahvistavat, ettei ravinnon kolesterolin saannin ja seerumin kolesterolitasojen välillä ole suoraa yhteyttä [62].
Ottaen huomioon kaikki todisteet ketogeenisen ruokavalion vaikutuksesta veren lipidiprofiiliin, on olemassa ylivoimaisesti eniten näyttöä hyödyllisestä vaikutuksesta.
On vain vähän näyttöä siitä, että ketogeenisellä ruokavaliolla olisi huonompi vaikutus kokonaislipidiprofiiliin verrattuna muihin ruokavalioihin. Usein, vaikka sillä ei olisikaan suurempia hyötyjä, sillä on verrattavissa oleva hyödyllinen vaikutus kontrolliruokavalioon verrattuna. Tämä on sitäkin optimistisempaa, kun otetaan huomioon, että kolesterolihypoteesia sydän- ja verisuonitautien riskin yhteydessä ehdottavat tutkimukset eivät täytä Bradford Hillin syy-yhteyden kriteerejä [26].
Tutkimusten tulokset ovat epäselviä. Monissa tutkimuksissa LDL-kolesterolin osuus on laskenut. Toisaalta, vaikka se joissain tutkimuksissa olisikin kohonnut, LDL:n korrelaatio sydän- ja verisuonisairauksiin ei välttämättä tarkoita syy-yhteyttä.
On jopa osoitettu, että ihmiset, joilla on korkeimmat LDL-kolesterolin pitoisuudet, elävät yhtä kauan tai useimmissa tapauksissa pidempään kuin ne, joilla on normaalit tai matalat LDL-pitoisuudet [63,64].
Tutkimustulosten perusteella ei kuitenkaan voida muodostaa kiistatonta yksimielisyyttä, vaikka saatavilla oleva tieteellinen näyttö osoittaa enimmäkseen ketogeenisen ruokavalion positiivisen vaikutuksen veren lipidiprofiiliin.
Lähdeluettelo
1. [(accessed on 4 March 2023)]. Available online: https://www.who.int/health-topics/cardiovascular-diseases#tab=tab_1.
2.Tsao C.W., Aday A.W., Almarzooq Z.I., Alonso A., Beaton A.Z., Bittencourt M.S., Boehme A.K., Buxton A.E., Carson A.P., Commodore-Mensah Y., et al. Heart Disease and Stroke Statistics-2022 Update: A Report from the American Heart Association. Circulation. 2022;145:e153–e639. doi: 10.1161/CIR.0000000000001052. Erratum in Circulation 2022, 146, e141. [DOI] [PubMed] [Google Scholar]
3.Roth G.A., Mensah G.A., Johnson C.O., Addolorato G., Ammirati E., Baddour L.M., Barengo N.C., Beaton A.Z., Benjamin E.J., Benziger C.P., et al. Global Burden of Cardiovascular Diseases and Risk Factors, 1990–2019: Update from the GBD 2019 Study. J. Am. Coll. Cardiol. 2020;76:2982–3021. doi: 10.1016/j.jacc.2020.11.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
4. [(accessed on 4 March 2023)]. Available online: https://www.who.int/news-room/fact-sheets/detail/cancer.
5.Mathers C.D., Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3:e442. doi: 10.1371/journal.pmed.0030442. [DOI] [PMC free article] [PubMed] [Google Scholar]
6. [(accessed on 4 March 2023)]; Available online: https://www.cdc.gov/chronicdisease/resources/publications/factsheets/heart-disease-stroke.htm.
7.Vancheri F., Longo G., Vancheri E., Henein M.Y. MentalStress and Cardiovascular Health—Part I. J. Clin. Med. 2022;11:3353. doi: 10.3390/jcm11123353. [DOI] [PMC free article] [PubMed] [Google Scholar]
8.Cosentino N., Campodonico J., Milazzo V., De Metrio M., Brambilla M., Camera M., Marenzi G. Vitamin D and Cardiovascular Disease: Current Evidence and Future Perspectives. Nutrients. 2021;13:3603. doi: 10.3390/nu13103603. [DOI] [PMC free article] [PubMed] [Google Scholar]
9.Muzaffar R., Khan M.A., Mushtaq M.H., Nasir M., Khan A., Haq I.U., Muhammad J. Hyperhomocysteinemia as an Independent Risk Factor for Coronary Heart Disease. Comparison with Conventional Risk Factors. Braz. J. Biol. 2021;83:e249104. doi: 10.1590/1519-6984.249104. [DOI] [PubMed] [Google Scholar]
10.Khan M.S., Saeedullah A., Andrews S.C., Iqbal K., Qadir S.A., Shahzad B., Ahmed Z., Shahzad M. Adolescent Afghan Refugees Display a High Prevalence of Hyperhomocysteinemia and Associated Micronutrients Deficiencies Indicating an Enhanced Risk of Cardiovascular Disease in Later Life. Nutrients. 2022;14:1751. doi: 10.3390/nu14091751. [DOI] [PMC free article] [PubMed] [Google Scholar]
11.Xiao K., Chen Y., Xiao L., Sun H., He Z., Huang G., Chen L., Xv L., Peng L., Li J., et al. The relationship between hyperhomocysteinemia and total coronary artery occlusion: A cross-sectional study from Southwest China. Coron. Artery Dis. 2023;34:138–145. doi: 10.1097/MCA.0000000000001217. [DOI] [PubMed] [Google Scholar]
12.Tyrovola D., Soulaidopoulos S., Tsioufis C., Lazaros G. The Role of Nutrition in Cardiovascular Disease: Current Concepts and Trends. Nutrients. 2023;15:1064. doi: 10.3390/nu15051064. [DOI] [PMC free article] [PubMed] [Google Scholar]
13.Kahleova H., Levin S., Barnard N.D. Vegetarian Dietary Patterns and Cardiovascular Disease. Prog. Cardiovasc. Dis. 2018;61:54–61. doi: 10.1016/j.pcad.2018.05.002. [DOI] [PubMed] [Google Scholar]
14.Arnett D.K., Blumenthal R.S., Albert M.A., Buroker A.B., Goldberger Z.D., Hahn E.J., Himmelfarb C.D., Khera A., Lloyd-Jones D., McEvoy J.W., et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140:596–646. doi: 10.1161/CIR.0000000000000678. [DOI] [PMC free article] [PubMed] [Google Scholar]
15.Mitrou P.N., Kipnis V., Thiébaut A.C., Reedy J., Subar A.F., Wirfält E., Flood A., Mouw T., Hollenbeck A.R., Leitzmann M.F., et al. Mediterranean dietary pattern and prediction of all-cause mortality in a US population: Results from the NIH–AARP diet and health study. Arch. Intern. Med. 2007;167:2461–2468. doi: 10.1001/archinte.167.22.2461. [DOI] [PubMed] [Google Scholar]
16.Fung T.T., Rexrode K.M., Mantzoros C.S., Manson J.E., Willett W.C., Hu F.B. Mediterranean diet and incidence of and mortality from coronary heart disease and stroke in women. Circulation. 2009;119:1093–1100. doi: 10.1161/CIRCULATIONAHA.108.816736. [DOI] [PMC free article] [PubMed] [Google Scholar]
17.Chiavaroli L., Viguiliouk E., Nishi S.K., Blanco Mejia S., Rahelić D., Kahleová H., Salas-Salvadó J., Kendall C.W., Sievenpiper J.L. DASH Dietary Pattern and Cardiometabolic Outcomes: An Umbrella Review of Systematic Reviews and Meta-Analyses. Nutrients. 2019;11:338. doi: 10.3390/nu11020338. [DOI] [PMC free article] [PubMed] [Google Scholar]
18.Eckel R.H., Jakicic J.M., Ard J.D., de Jesus J.M., Miller N.H., Hubbard V.S., Lee I.M., Lichtenstein A.H., Loria C.M., Millen B.E., et al. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: A report of the American College of Cardiology/American Heart Association task force on practice guidelines. J. Am. Coll. Cardiol. 2014;63:2960–2984. doi: 10.1016/j.jacc.2013.11.003. [DOI] [PubMed] [Google Scholar]
19.Wilson J., Lowery R. The Ketogenic Bible. Victory Belt Publishing Inc.; Las Vegas, NV, USA: 2017. [Google Scholar]
20.Gardner C.D., Vadiveloo M.K., Petersen K.S., Anderson C.A.M., Springfield S., Van Horn L., Khera A., Lamendola C., Mayo S.M., Joseph J.J. American Heart Association Council on Lifestyle and Cardiometabolic Health. Popular Dietary Patterns: Alignment with American Heart Association 2021 Dietary Guidance: A Scientific Statement from the American Heart Association. Circulation. 2023;147:1715–1730. doi: 10.1161/CIR.0000000000001146. [DOI] [PubMed] [Google Scholar]
21.Du Z., Qin Y. Dyslipidemia and Cardiovascular Disease: Current Knowledge, Existing Challenges, and New Opportunities for Management Strategies. J. Clin. Med. 2023;12:363. doi: 10.3390/jcm12010363. [DOI] [PMC free article] [PubMed] [Google Scholar]
22.Jung E., Kong S.Y., Ro Y.S., Ryu H.H., Shin S.D. Serum Cholesterol Levels and Risk of Cardiovascular Death: A Systematic Review and a Dose-Response Meta-Analysis of Prospective Cohort Studies. Int. J. Environ. Res. Public Health. 2022;19:8272. doi: 10.3390/ijerph19148272. [DOI] [PMC free article] [PubMed] [Google Scholar]
23.Dong J., Yang S., Zhuang Q., Sun J., Wei P., Zhao X., Chen Y., Chen X., Li M., Wei L., et al. The Associations of Lipid Profiles With Cardiovascular Diseases and Death in a 10-Year Prospective Cohort Study. Front. Cardiovasc. Med. 2021;8:745539. doi: 10.3389/fcvm.2021.745539. [DOI] [PMC free article] [PubMed] [Google Scholar]
24.Yi S.W., Yi J.J., Ohrr H. Total cholesterol and all-cause mortality by sex and age: A prospective cohort study among 12.8 million adults. Sci. Rep. 2019;9:1596. doi: 10.1038/s41598-018-38461-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
25.BHF-HEART STATS and WHO-MORTALITY (Adapted). Total Cholesterol Levels vs Mortality Data from 164 Countries, 2005. [(accessed on 23 July 2023)]. Available online: https://renegadewellness.files.wordpress.com/2011/02/cholesterol-mortality-chart.pdf.
26.Ravnskov U., de Lorgeril M., Diamond D.M., Hama R., Hamazaki T., Hammarskjöld B., Hynes N., Kendrick M., Langsjoen P.H., Mascitelli L., et al. LDL-C does not cause cardiovascular disease: A comprehensive review of the current literature. Expert Rev. Clin. Pharmacol. 2018;11:959–970. doi: 10.1080/17512433.2018.1519391. [DOI] [PubMed] [Google Scholar]
27.Borén J., Chapman M.J., Krauss R.M., Packard C.J., Bentzon J.F., Binder C.J., Daemen M.J., Demer L.L., Hegele R.A., Nicholls S.J., et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease: Pathophysiological, genetic, and therapeutic insights: A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur. Heart J. 2020;41:2313–2330. doi: 10.1093/eurheartj/ehz962. [DOI] [PMC free article] [PubMed] [Google Scholar]
28.Peng K.M., Li X., Wang Z., Li M.M., Yang Y. Association of low-density lipoprotein cholesterol levels with the risk of mortality and cardiovascular events: A meta-analysis of cohort studies with 1,232,694 participants. Medicine. 2022;101:e32003. doi: 10.1097/MD.0000000000032003. [DOI] [PMC free article] [PubMed] [Google Scholar]
29.Bhargava S., de la Puente-Secades S., Schurgers L., Jankowski J. Lipids and lipoproteins in cardiovascular diseases: A classification. Trends Endocrinol. Metab. 2022;33:409–423. doi: 10.1016/j.tem.2022.02.001. [DOI] [PubMed] [Google Scholar]
30.Kim Y.G., Jeong J.H., Han K.D., Roh S.Y., Min K., Lee H.S., Choi Y.Y., Shim J., Choi J.I., Kim Y.H. Association between low-density lipoprotein cholesterol and sudden cardiac arrest in people with diabetes mellitus. Cardiovasc. Diabetol. 2023;22:36. doi: 10.1186/s12933-023-01769-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
31.Rong S., Li B., Chen L., Sun Y., Du Y., Liu B., Robinson J.G., Bao W. Association of Low-Density Lipoprotein Cholesterol Levels with More than 20-Year Risk of Cardiovascular and All-Cause Mortality in the General Population. J. Am. Heart Assoc. 2022;11:e023690. doi: 10.1161/JAHA.121.023690. [DOI] [PMC free article] [PubMed] [Google Scholar]
32.Feingold K.R. In: Utility of Advanced Lipoprotein Testing in Clinical Practice. Feingold K.R., Anawalt B., Blackman M.R., Boyce A., Chrousos G., Corpas E., de Herder W.W., Dhatariya K., Dungan K., Hofland J., editors. MDText.com, Inc.; South Dartmouth, MA, USA: 2000. Endotext [Internet] [Google Scholar]
33.Nicholls S.J., Nelson A.J. HDL and cardiovascular disease. Pathology. 2019;51:142–147. doi: 10.1016/j.pathol.2018.10.017. [DOI] [PubMed] [Google Scholar]
34.Trimarco V., Izzo R., Morisco C., Mone P., Virginia Manzi M., Falco A., Pacella D., Gallo P., Lembo M., Santulli G., et al. High HDL (High-Density Lipoprotein) Cholesterol Increases Cardiovascular Risk in Hypertensive Patients. Hypertension. 2022;79:2355–2363. doi: 10.1161/HYPERTENSIONAHA.122.19912. [DOI] [PMC free article] [PubMed] [Google Scholar]
35.Cho Y.K., Jung C.H. HDL-C and Cardiovascular Risk: You Don’t Need to Worry about Extremely High HDL-C Levels. J. Lipid Atheroscler. 2021;10:57–61. doi: 10.12997/jla.2021.10.1.57. [DOI] [PMC free article] [PubMed] [Google Scholar]
36.Farnier M., Zeller M., Masson D., Cottin Y. Triglycerides and risk of atherosclerotic cardiovascular disease: An update. Arch Cardiovasc. Dis. 2021;114:132–139. doi: 10.1016/j.acvd.2020.11.006. [DOI] [PubMed] [Google Scholar]
37.Xia T.L., Li Y.M., Huang F.Y., Chai H., Huang B.T., Li Q., Zhao Z.-G., Liao Y.-B., Zuo Z.L., Peng Y., et al. The triglyceride paradox in the mortality of coronary artery disease. Lipids Health Dis. 2019;18:21. doi: 10.1186/s12944-019-0972-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
38.Jain M., Jain A., Yerragondu N., Brown R.D., Rabinstein A., Jahromi B.S., Vaidyanathan L., Blyth B., Stead L.G. The triglyceride paradox in stroke survivors: A prospective study. Neurosci. J. 2013;2013:870608. doi: 10.1155/2013/870608. [DOI] [PMC free article] [PubMed] [Google Scholar]
39.Kosmas C.E., Rodriguez Polanco S., Bousvarou M.D., Papakonstantinou E.J., Peña Genao E., Guzman E., Kostara C.E. The Triglyceride/High-Density Lipoprotein Cholesterol (TG/HDL-C) Ratio as a Risk Marker for Metabolic Syndrome and Cardiovascular Disease. Diagnostics. 2023;13:929. doi: 10.3390/diagnostics13050929. [DOI] [PMC free article] [PubMed] [Google Scholar]
40.Wu Z., Wang J., Zhang H., Pan H., Li Z., Liu Y., Miao X., Han Z., Kang X., Li X., et al. Longitudinal association of remnant cholesterol with joint arteriosclerosis and atherosclerosis progression beyond LDL cholesterol. BMC Med. 2023;21:42. doi: 10.1186/s12916-023-02733-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
41.Varbo A., Freiberg J.J., Nordestgaard B.G. Extreme Nonfasting Remnant Cholesterol vs Extreme LDL Cholesterol as Contributors to Cardiovascular Disease and All-Cause Mortality in 90,000 Individuals from the General Population. Clin. Chem. 2015;61:533–543. doi: 10.1373/clinchem.2014.234146. [DOI] [PubMed] [Google Scholar]
42.Tamang H.K., Timilsina U., Singh K.P., Shrestha S., Raman R.K., Panta P., Karna P., Khadka L., Dahal C. Apo B/Apo A-I Ratio is Statistically A Better Predictor of Cardiovascular Disease (CVD) than Conventional Lipid Profile: A Study from Kathmandu Valley, Nepal. J. Clin. Diagn. Res. 2014;8:34–36. doi: 10.7860/JCDR/2014/7588.4000. [DOI] [PMC free article] [PubMed] [Google Scholar]
43.Li S., Lin G., Chen J., Chen Z., Xu F., Zhu F., Zhang J., Yuan S. The effect of periodic ketogenic diet on newly diagnosed overweight or obese patients with type 2 diabetes. BMC Endocr. Disord. 2022;22:34. doi: 10.1186/s12902-022-00947-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
44.Gardner C.D., Landry M.J., Perelman D., Petlura C., Durand L.R., Aronica L., Crimarco A., Cunanan K.M., Chang A., Dant C.C., et al. Effect of a ketogenic diet versus Mediterranean diet on glycated hemoglobin in individuals with prediabetes and type 2 diabetes mellitus: The interventional Keto-Med randomized crossover trial. Am. J. Clin. Nutr. 2022;116:640–652. doi: 10.1093/ajcn/nqac154. Erratum in Am. J. Clin. Nutr. 2022, 116, 1904. [DOI] [PMC free article] [PubMed] [Google Scholar]
45.Schiavo L., Pierro R., Asteria C., Calabrese P., Di Biasio A., Coluzzi I., Severino L., Giovanelli A., Pilone V., Silecchia G. Low-Calorie Ketogenic Diet with Continuous Positive Airway Pressure to Alleviate Severe Obstructive Sleep Apnea Syndrome in Patients with Obesity Scheduled for Bariatric/Metabolic Surgery: A Pilot, Prospective, Randomized Multicenter Comparative Study. Obes. Surg. 2022;32:634–642. doi: 10.1007/s11695-021-05811-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
46.Vidić V., Ilić V., Toskić L., Janković N., Ugarković D. Effects of calorie restricted low carbohydrate high fat ketogenic vs. non-ketogenic diet on strength, body-composition, hormonal and lipid profile in trained middle-aged men. Clin. Nutr. 2021;40:1495–1502. doi: 10.1016/j.clnu.2021.02.028. [DOI] [PubMed] [Google Scholar]
47.Burén J., Ericsson M., Damasceno N.R.T., Sjödin A. A Ketogenic Low-Carbohydrate High-Fat Diet Increases LDL Cholesterol in Healthy, Young, Normal-Weight Women: A Randomized Controlled Feeding Trial. Nutrients. 2021;13:814. doi: 10.3390/nu13030814. [DOI] [PMC free article] [PubMed] [Google Scholar]
48.Ravnskov U. Is High Cholesterol Deleterious? An Alternative Point of View. Comment on Burén et al. A Ketogenic Low-Carbohydrate High-Fat Diet Increases LDL Cholesterol in Healthy, Young, Normal-Weight Women: A Randomized Controlled Feeding Trial. Nutrients. 2021;13:814. doi: 10.3390/nu13062119. Nutrients2021, 13, 2119. [DOI] [PMC free article] [PubMed] [Google Scholar]
49.Basciani S., Camajani E., Contini S., Persichetti A., Risi R., Bertoldi L., Strigari L., Prossomariti G., Watanabe M., Mariani S., et al. Very-Low-Calorie Ketogenic Diets with Whey, Vegetable, or Animal Protein in Patients with Obesity: A Randomized Pilot Study. J. Clin. Endocrinol. Metab. 2020;105:dgaa336. doi: 10.1210/clinem/dgaa336. [DOI] [PubMed] [Google Scholar]
50.Michalczyk M.M., Klonek G., Maszczyk A., Zajac A. The Effects of a Low Calorie Ketogenic Diet on Glycaemic Control Variables in Hyperinsulinemic Overweight/Obese Females. Nutrients. 2020;12:1854. doi: 10.3390/nu12061854. [DOI] [PMC free article] [PubMed] [Google Scholar]
51.Saslow L.R., Daubenmier J.J., Moskowitz J.T., Kim S., Murphy E.J., Phinney S.D., Ploutz-Snyder R., Goldman V., Cox R.M., Mason A.E., et al. Twelve-month outcomes of a randomized trial of a moderate-carbohydrate versus very low-carbohydrate diet in overweight adults with type 2 diabetes mellitus or prediabetes. Nutr. Diabetes. 2017;7:304. doi: 10.1038/s41387-017-0006-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
52.Paoli A., Moro T., Bosco G., Bianco A., Grimaldi K.A., Camporesi E., Mangar D. Effects of n-3 polyunsaturated fatty acids (ω-3) supplementation on some cardiovascular risk factors with a ketogenic Mediterranean diet. Mar. Drugs. 2015;13:996–1009. doi: 10.3390/md13020996. [DOI] [PMC free article] [PubMed] [Google Scholar]
53.Partsalaki I., Karvela A., Spiliotis B.E. Metabolic impact of a ketogenic diet compared to a hypocaloric diet in obese children and adolescents. J. Pediatr. Endocrinol. Metab. 2012;25:697–704. doi: 10.1515/jpem-2012-0131. [DOI] [PubMed] [Google Scholar]
54.Amanollahi A., Khazdouz M., Malekahmadi M., Klement R.J., Lee D., Khodabakhshi A. Effect of Ketogenic Diets on Cardio-Metabolic Outcomes in Cancer Patients: A Systematic Review and Meta-Analysis of Controlled Clinical Trials. Nutr. Cancer. 2023;75:95–111. doi: 10.1080/01635581.2022.2117388. [DOI] [PubMed] [Google Scholar]
55.Li M., Yuan J. Effects of very low-carbohydrate ketogenic diet on lipid metabolism in patients with type II diabetes mellitus: A meta-analysis. Nutr. Hosp. 2022;39:916–923. doi: 10.20960/nh.03987. English. [DOI] [PubMed] [Google Scholar]
56.Rafiullah M., Musambil M., David S.K. Effect of a very low-carbohydrate ketogenic diet vs recommended diets in patients with type 2 diabetes: A meta-analysis. Nutr. Rev. 2022;80:488–502. doi: 10.1093/nutrit/nuab040. [DOI] [PubMed] [Google Scholar]
57.Yuan X., Wang J., Yang S., Gao M., Cao L., Li X., Hong D., Tian S., Sun C. Effect of the ketogenic diet on glycemic control, insulin resistance, and lipid metabolism in patients with T2DM: A systematic review and meta-analysis. Nutr. Diabetes. 2020;10:38. doi: 10.1038/s41387-020-00142-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
58.López-Espinoza M.Á., Chacón-Moscoso S., Sanduvete-Chaves S., Ortega-Maureira M.J., Barrientos-Bravo T. Effect of a Ketogenic Diet on the Nutritional Parameters of Obese Patients: A Systematic Review and Meta-Analysis. Nutrients. 2021;13:2946. doi: 10.3390/nu13092946. [DOI] [PMC free article] [PubMed] [Google Scholar]
59.Muscogiuri G., El Ghoch M., Colao A., Hassapidou M., Yumuk V., Busetto L. Obesity Management Task Force (OMTF) of the European Association for the Study of Obesity (EASO). European Guidelines for Obesity Management in Adults with a Very Low-Calorie Ketogenic Diet: A Systematic Review and Meta-Analysis. Obes. Facts. 2021;14:222–245. doi: 10.1159/000515381. [DOI] [PMC free article] [PubMed] [Google Scholar]
60.Castellana M., Conte E., Cignarelli A., Perrini S., Giustina A., Giovanella L., Giorgino F., Trimboli P. Efficacy and safety of very low calorie ketogenic diet (VLCKD) in patients with overweight and obesity: A systematic review and meta-analysis. Rev. Endocr. Metab. Disord. 2020;21:5–16. doi: 10.1007/s11154-019-09514-y. [DOI] [PubMed] [Google Scholar]
61.Kern F., Jr. Normal plasma cholesterol in an 88-year-old man who eats 25 eggs a day. Mechanisms of adaptation. N. Engl. J. Med. 1991;324:896–899. doi: 10.1056/NEJM199103283241306. [DOI] [PubMed] [Google Scholar]
62.Fernandez M.L., Murillo A.G. Is There a Correlation between Dietary and Blood Cholesterol? Evidence from Epidemiological Data and Clinical Interventions. Nutrients. 2022;14:2168. doi: 10.3390/nu14102168. [DOI] [PMC free article] [PubMed] [Google Scholar]
63.Ravnskov U., Diamond D.M., Hama R., Hamazaki T., Hammarskjöld B., Hynes N., Kendrick M., Langsjoen P.H., Malhotra A., Mascitelli L., et al. Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: A systematic review. BMJ Open. 2016;6:e010401. doi: 10.1136/bmjopen-2015-010401. [DOI] [PMC free article] [PubMed] [Google Scholar]
64.Ravnskov U., de Lorgeril M., Diamond D.M., Hama R., Hamazaki T., Hammarskjöld B., Harcombe Z., Kendrick M., Langsjoen P.H., McCully K.S., et al. The LDL paradox: Higher LDL-cholesterol is associated with greater longevity. Ann. Epidemiol. Public Health. 2020;3:1040–1047. [Google Scholar]











 Lähde: https://www.hindawi.com/journals/jnme/2018/7195760/
Lähde: https://www.hindawi.com/journals/jnme/2018/7195760/
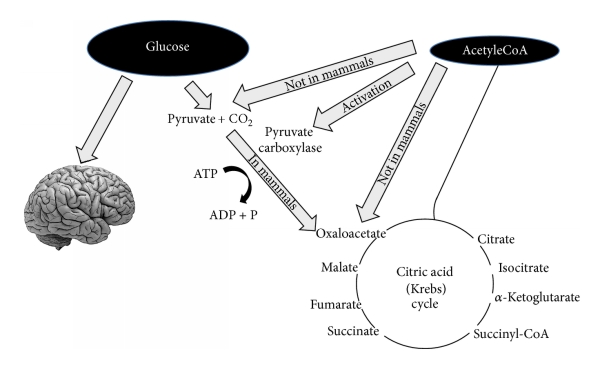
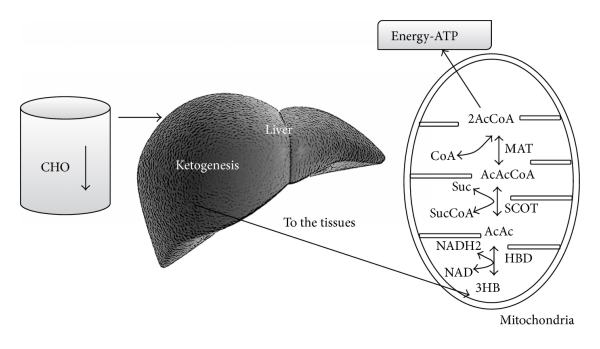 Keskushermostossa glukoosia tarvitaan energia lähteeksi, sekä tuottamaan pyruvaatteja, jotka voidaan edelleen muuntaa oksaloasetaatiksi.
Keskushermostossa glukoosia tarvitaan energia lähteeksi, sekä tuottamaan pyruvaatteja, jotka voidaan edelleen muuntaa oksaloasetaatiksi.